题目内容
【题目】稀硫酸与氢氧化钠溶液混合没有明显现象,为证明硫酸与氢氧化钠发生了化学反应,小颖同学进行了如下探究:
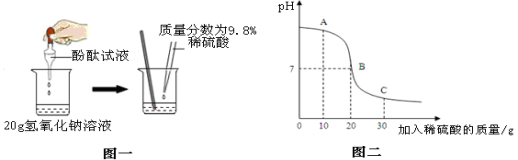
(1)小颖同学通过图一所示的实验,证明硫酸与氢氧化钠发生了化学反应,她依据的实验现象是 。
(2)氢氧化钠是实验室常用药品,下列相关说法中,正确的是 (填序号)。
A.称量:可将NaOH固体直接放在天平左边托盘的纸上进行称量
B.溶解:NaOH固体溶于水时放出大量热,溶解时需用玻璃棒不断搅拌
C.应急:先用大量水冲洗皮肤上的NaOH溶液,再涂上3%~5%稀盐酸溶液
D.保存:NaOH固体易吸收空气中的水蒸气和CO2,应密封保存
(3)溶液的pH与加入稀硫酸的质量关系如图二所示,图中A点对应溶液中的溶质有 (写化学式)
(4)根据图示信息,当溶液恰好为中性时,求所得不饱和溶液中溶质的质量。(不计滴加的酚酞试液质量,计算精确到0.01g)
【答案】(1)溶液由红色变为无色(2) BD (3)NaOH、Na2SO4 (4)2.84g
【解析】
试题分析:(1)氢氧化钠显碱性,能使酚酞试液变为红色,盐酸与氢氧化钠反应生成氯化钠和水,氯化钠显中性,不能使酚酞试液变红,所以溶液由红色变为无色
(2)NaOH固体是种具有腐蚀性的药品,不能直接放在天平左边托盘的纸上进行称量,A错误;NaOH固体溶于水时放出大量热,溶解时需用玻璃棒不断搅拌,B正确;先用大量水冲洗皮肤上的NaOH溶液,再涂上3%~5%稀硼酸溶液,C错误;NaOH固体易吸收空气中的水蒸气和CO2,应密封保存,D正确。
(3)A点处于碱剩余,故溶液中的溶质有NaOH、Na2SO4
(4)解:H2SO4质量 = 20g × 9.8% = 1.96 g
设Na2SO4质量为x,则
H2SO4+2NaOH=Na2SO4 + 2H2O
98 142
1.96g x
98/142 =19.6g/x ,
得 x = 2.84g

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案