题目内容
【题目】海洋是人类的母亲,是人类千万年来取之不尽、用之不竭的巨大资源宝库。
(1)今年5月我国在海域可燃冰开采技术领域取得重大突破。可燃冰主要含有甲烷水合物,还含有少量CO2等气体,可燃冰属于_____(选填“纯净物”或“混合物”)。若甲烷大量泄漏到大气中,会导致_____,使全球气候变暖;甲烷燃烧的化学方程式为_____。
(2)海水碳储存,可以缓解空气中CO2过多的问题,但海水的pH也在逐渐减小,同时软体生物贝壳也在逐渐软化、变薄缩小。(图1)
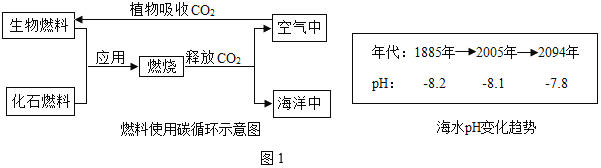
①根据海水pH变化趋势判断:2000年时海水呈_____性。
②“海洋酸化”的原因可用化学方程式表示为_____。
③软化生物贝壳软化、变薄的原因是_____。
(3)从海水中得到金属镁。如图2是从海水中提取镁的简单流程。
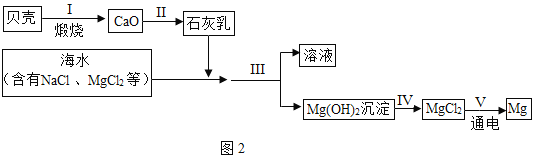
①步骤Ⅲ、Ⅳ的化学反应方程式分别是_____、_____。
②从海水中提取氯化镁时,经历了步骤Ⅲ、Ⅳ的转化过程,这样做的目的是什么_____。
③上述过程中,你认为其优点是_____。
【答案】混合物 温室效应 CH4+2O2![]() CO2+2H2O 碱 CO2+H2O═H2CO3 “海洋酸化”会溶解、腐蚀贝壳中的碳酸钙 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 Mg(OH)2↓+2HCl=MgCl2+2H2O 是为了将氯化镁聚集起来,获得比较纯净的氯化镁 充分利用自然资源
CO2+2H2O 碱 CO2+H2O═H2CO3 “海洋酸化”会溶解、腐蚀贝壳中的碳酸钙 Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2 Mg(OH)2↓+2HCl=MgCl2+2H2O 是为了将氯化镁聚集起来,获得比较纯净的氯化镁 充分利用自然资源
【解析】
(1)可燃冰属于混合物;若甲烷大量泄漏到大气中,会导致温室效应,使全球气候变暖;甲烷燃烧生成二氧化碳和水,该反应的化学方程式为CH4+2O2![]() CO2+2H2O,故填:混合物;温室效应;CH4+2O2
CO2+2H2O,故填:混合物;温室效应;CH4+2O2![]() CO2+2H2O
CO2+2H2O
(2)①根据海水pH变化趋势判断:2000年时海水的pH大于7,呈碱性。故填:碱
②“海洋酸化”的原因是二氧化碳和水反应生成碳酸,反应的化学方程式表示为:CO2+H2O═H2CO3。故填:CO2+H2O═H2CO3
③软化生物贝壳软化、变薄的原因是“海洋酸化”会溶解、腐蚀贝壳中的碳酸钙。故填:“海洋酸化”会溶解、腐蚀贝壳中的碳酸钙。
(3)①步骤Ⅲ是用石灰乳把镁离子沉淀下来,反应方程式是:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;步骤Ⅳ是把氢氧化镁转化为氯化镁,其化学反应方程式分别是:Mg(OH)2↓+2HCl=MgCl2+2H2O。故填:Ca(OH)2+MgCl2=Mg(OH)2↓+CaCl2;Mg(OH)2↓+2HCl=MgCl2+2H2O
②从海水中提取氯化镁时,经历了步骤Ⅲ、Ⅳ的转化过程,这样做的目的是:海水中含有的氯化镁浓度较低,加入石灰乳变为氢氧化镁沉淀,过滤后加入盐酸制备氯化镁,再经过蒸发干燥制备无水氯化镁,最后经过通电可制得镁;通过前两步反应我们将氯化镁富集起来。故填:是为了将氯化镁聚集起来,获得比较纯净的氯化镁
③上述过程中,从自然界中提取出更多有用的物质,可以做到充分利用自然资源。故填:充分利用自然资源

【题目】工业上常采用“双碱法”除去烟气中的![]() ,工业流程示意图如下.
,工业流程示意图如下.
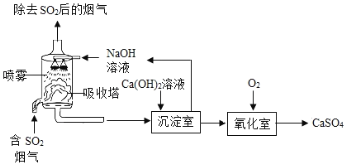
(1)吸收塔中,用NaOH溶液吸收![]() ,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
,化学反应方程式是___.NaOH溶液喷成雾状能充分吸收SO2的原因是_____
(2)氧化室中,化学反应方程式是_______。
(3)已知部分原料的价格如表所示.
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.90 |
上述工业流程中,处理相同量的![]() ,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
,双碱法所需的原料成本比用NaOH直接吸收更低,原因是___
(4)某中学化学兴趣小组为测定工厂周围的空气中的二氧化硫含量是否符合国家标准,将![]() 周围空气通入一定含量碘(
周围空气通入一定含量碘(![]() )2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是
)2.54mg的碘水中,经测定I2与二氧化硫恰好完全反应,该反应的化学方程式是![]() 。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
。通过计算说明此烟气排放后周围空气中二氧化硫的浓度级别______。
[资料信息:我国空气质量标准对空气中二氧化硫的浓度级别规定如下表所示(空气中二氧化硫的浓度用单位体积的空气中所含二氧化硫的质量表示)]。
浓度级别 | 标准(mg·m-3) |
一级 | 浓度≤0.15 |
二级 | 0.15<浓度≤0.50 |
三级 | 0.50<浓度≤0.70 |