题目内容
【题目】X、Y、Z三种物质的溶解度曲线如右图所示。下列叙述中,正确的是( )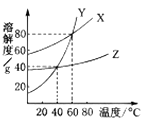
A.40℃时Z的溶解度最大
B.三种物质的饱和溶液,温度由60℃降至40℃时,Y析出的晶体最多
C.40℃时,Z和Y的饱和溶液的溶质质量分数相同
D.40℃时,X、Y、Z的饱和溶液升温至60℃,溶质质量分数X=Y>Z
【答案】C
【解析】A、根据溶解度曲线,40℃时X的溶解度最大,A不符合题意,
B、根据溶解度曲线,Y物质的溶解度随温度的变化趋势最大,故等质量三种物质的饱和溶液,温度由60℃降至40℃时,Y析出的晶体最多,但这里没有注明是否为等质量,B不符合题意,
C、根据溶解度曲线,40℃时,Z和Y的溶解度相等,故两者的饱和溶液的溶质质量分数相同,C符合题意
D,根据溶解度曲线,三种物质的溶解度都随温度的升高而增大,故将400C时饱和溶液升温至60℃,都由饱和溶液变为不饱和溶液,但溶液中的溶质、溶剂质量仍然保持不变,溶质质量分数自然也不变,故只要比较400C时饱和溶液溶质质量分数的大小关系,而在400C 时,三种物质的溶解度大小关系是:X>Y=Z,故三种饱和溶液中溶质的质量分数大小关系是:X>Y=Z,D不符合题意
所以答案是:C
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和),以及对溶质的质量分数的理解,了解溶质的质量分数=(溶质质量/溶液质量)*100% = [溶质质量/(溶质质量+溶剂质量]*100%.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目