题目内容
5.6克不纯的铁与足量的盐酸反应,得到0.22克氢气,则所含的杂质可能为( )A.Zn
B.Mg
C.Cu
D.FeO
【答案】分析:根据铁与盐酸反应的化学方程式可以计算出5.6g纯铁能生成0.2g氢气.由于0.2g<0.22g,说明不纯的铁中所含的杂质能与盐酸反应且能产生氢气,而且等质量的铁和所含杂质相比,杂质与盐酸反应产生的氢气多.
解答:解:铜在金属活动顺序表中排在氢的后面,说明铜不能与盐酸反应,因此排除选项C.
氧化亚铁与盐酸反应不能产生氢气,因此排除选项D.
由于镁、锌、铁的相对原子质量由小到大的顺序是:镁<铁<锌,
因此等质量的镁、锌、铁与盐酸反应时产生的氢气质量由多到少的顺序是:镁>铁>锌.
设5.6g纯铁与盐酸反应生成氢气的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
5.6g x
 =
=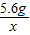 ,x=0.2g<0.22g
,x=0.2g<0.22g
说明等质量的铁和杂质与盐酸反应时杂质产生的氢气多
结合上述分析说明杂质为镁.
故选B.
点评:本题的关键是所含杂质:能与盐酸反应、能产生氢气、与铁的质量相等时比铁产生的氢气多.
解答:解:铜在金属活动顺序表中排在氢的后面,说明铜不能与盐酸反应,因此排除选项C.
氧化亚铁与盐酸反应不能产生氢气,因此排除选项D.
由于镁、锌、铁的相对原子质量由小到大的顺序是:镁<铁<锌,
因此等质量的镁、锌、铁与盐酸反应时产生的氢气质量由多到少的顺序是:镁>铁>锌.
设5.6g纯铁与盐酸反应生成氢气的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
5.6g x
 =
=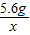 ,x=0.2g<0.22g
,x=0.2g<0.22g说明等质量的铁和杂质与盐酸反应时杂质产生的氢气多
结合上述分析说明杂质为镁.
故选B.
点评:本题的关键是所含杂质:能与盐酸反应、能产生氢气、与铁的质量相等时比铁产生的氢气多.

练习册系列答案
相关题目
5.6克不纯的铁与足量的盐酸反应,得到0.22克氢气,则所含的杂质可能为( )
| A、Zn | B、Mg | C、Cu | D、FeO |