题目内容
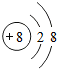 有A、B、C、D四种元素,A元素的原子没有中子;B元素的离子结构示意图如右图所示;C+的核外电子排布与氖原子相同,D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1.
有A、B、C、D四种元素,A元素的原子没有中子;B元素的离子结构示意图如右图所示;C+的核外电子排布与氖原子相同,D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1.试回答:(1)A、D二种元素的名称或符号是:A
氢或H
氢或H
、D氯或Cl
氯或Cl
;(2)B、C二种元素的离子符号:B
O2-
O2-
、CNa+
Na+
;(3)C、D二种元素组成化合物的化学式是
NaCl
NaCl
.分析:根据A元素的原子没有中子,可推断出该元素为H;B元素的离子结构示意图可知B元素为第八号元素,可以知道B为氧元素;根据C+的核外电子排布与氖原子相同,结合离子的形成过程可以知道,C失去一个电子,带一个单位的正电荷,而氖原子核内有10个质子,可推知C的质子数为11,可知该元素为钠元素;根据D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1,由此可知;2+x=8+1,x=7,最外层电子数为7,所以D元素的质子数为17,为Cl,可以据此完成该题的解答.
解答:解:(1)根据A元素的原子没有中子,可推断出A元素为H;根据D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1,由此可知;2+x=8+1,x=7,最外层电子数为7,所以D元素的质子数为17,为Cl;
(2)根据原子序数等于核内质子数,结合B元素的离子结构示意图可推出B元素为O,B元素的离子符号为:O2-;根据C+的核外电子排布与氖原子相同,失去一个电子,带一个单位的正电荷,可推知C的质子数为11,为Na元素;因此C元素的离子符号是Na+;
(3)根据D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1,由此可知;2+x=8+1,x=7,最外层电子数为7,所以D元素的质子数为17,为Cl;故C、D两种元素组成化合物的化学式为:NaCl.
故答案为:
(1)氢H;氯Cl;
(2)O2-;Na+;
(3)NaCl.
(2)根据原子序数等于核内质子数,结合B元素的离子结构示意图可推出B元素为O,B元素的离子符号为:O2-;根据C+的核外电子排布与氖原子相同,失去一个电子,带一个单位的正电荷,可推知C的质子数为11,为Na元素;因此C元素的离子符号是Na+;
(3)根据D元素的原子有三个电子层,第一层和第三层电子数的和比第二层电子数多1,由此可知;2+x=8+1,x=7,最外层电子数为7,所以D元素的质子数为17,为Cl;故C、D两种元素组成化合物的化学式为:NaCl.
故答案为:
(1)氢H;氯Cl;
(2)O2-;Na+;
(3)NaCl.
点评:本考点考查了物质的推断中元素的推断,还考查了化学式和元素符号的书写,元素符号、化学式、化学方程式等化学用语的书写是中考的重要考点之一,要加强练习,理解应用.本考点主要出现在实验题和填空题中.

练习册系列答案
相关题目