题目内容
空气和海水是重要的自然资源,从空气和海水中分离出各种成分可更好地服务人类.
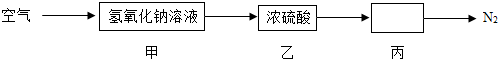
(1)某小组设计将空气依次经过甲、乙、丙三个装置,最终分离出较纯的N2
甲中可能发生反应的化学方程式为 ;乙中浓硫酸的作用是 ;丙中可以加入的试剂为 .
(2)海水中富含镁元素,下图是从海水中提取镁的流程图.
上述转化过程中,所发生的化学反应属于分解反应的是 (填序号),发生反应的化学方程式为 .
(3)海水经过日晒后,得到粗盐和食盐的饱和溶液.向一瓶食盐饱和溶液中加入一块规则的食盐晶体,保持温度和水的质量都不变,一段时间后,食盐晶体的形状 变化(填“有”或“无”).
(1)CO2+2NaOH═Na2CO3+H2O;吸收水蒸气;灼热的铜丝(合理均可);
(2)③;MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
(3)有.
解析试题分析:(1)根据二氧化碳可与氢氧化钠溶液反应,浓硫酸具有吸水性,氧气是空气的主要组成成分分析解答;
(2)根据反应流程分析化学反应,并据反应特点确定反应类型,根据反应原理书写化学方程式;
(3)在饱和溶液中,晶体的溶解速率等于溶液的析出速率,所以晶体的质量不变,但形状会越来越对称和接近圆.
解:(1)二氧化碳可与氢氧化钠溶液反应生成碳酸钠和水,反应方程式是:CO2+2NaOH═Na2CO3+H2O;浓硫酸具有吸水性,故通过浓硫酸可吸收水蒸气;氧气是空气的主要组成成分,要得到较纯净的氮气,还须除去氧气,可通过灼热的铜丝;
(2)海水的主要成分是氯化钠、氯化镁,通过石灰乳,氯化镁与氢氧化钙反应生成氢氧化镁和氯化钙是复分解反应,氢氧化镁与盐酸反应生成氯化镁和水是复分解反应,氯化镁通电分解成镁和氯气是由一种物质生成两种物质,属于分解反应,方程式是:MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
(3)在饱和溶液中,晶体的溶解速率等于溶液的析出速率,所以晶体的质量不变,但形状会越来越对称和接近圆;
故答案为:(1)CO2+2NaOH═Na2CO3+H2O;吸收水蒸气;灼热的铜丝(合理均可);
(2)③;MgCl2 Mg+Cl2↑;
Mg+Cl2↑;
(3)有.
考点:混合物的分离方法;物质的相互转化和制备.
点评:掌握物质的性质,饱和溶液的定义等知识,并能从流程图中分析和提取有用信息是解答此题的关键.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案