题目内容
【题目】实验室一般用锌和稀硫酸反应制取氢气。小明用此法制取氢气时发现问题:制得的氢气有刺激性气味。
提出问题:气味是哪来的?
查阅资料:锌与浓硫酸发生如下反应:Zn + H2SO4![]() ZnSO4 + SO2↑+ H2O
ZnSO4 + SO2↑+ H2O
SO2无色有刺激性气味的气体,化学性质与二氧化碳相似,且能使品红溶液退色。
猜想与假设:可能是硫酸的浓度过高,产生了有刺激性气味的SO2
设计实验:小明试设计了如下实验装置,用于探究活动。
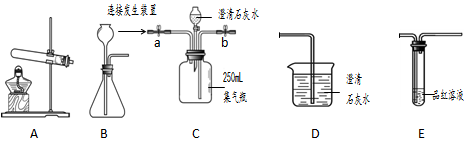
探究1:小明将发生装置与C、E连接,用1:2、1:3、1:4等不同浓度的硫酸进行实验。(温馨提示:上述比值是稀释浓硫酸时,浓硫酸与水的体积比)回答下列问题:
(1)C应连接的发生装置是__________。
(2)利用该组实验探究二氧化硫的产生与硫酸浓度的关系,小明判断有SO2产生的依据是_________。
(3)小明的该设计中,应该还有后续装置,其作用是__________。
探究2:探究SO2的体积含量。
小明想用C装置中测定收集到的气体中SO2的体积含量。应进行的操作是__________。计算二氧化硫含量的方法是___________。
【答案】探究1 (1)B(2)观察品红溶液是否退色(3)吸收SO2,避免污染空气
探究2 将a、b 关闭,并将右侧导管与D相连,打开分液漏斗活塞,放入一定量且足量的石灰水,震荡,打开b 瓶内液体总体积/瓶子容积
【解析】
试题分析:探究1(1)根据反应物的状态和反应条件选择发生装置,用锌和稀硫酸为原料制取氢气,属于固液体常温下的反应,故选B作为发生装置;
(2)要探究锌和硫酸反应是否生成了二氧化硫,根据资料可知可通过品红溶液来检验,即观察品红溶液是否退色;
(3)二氧化硫属空气污染物,故要将二氧化硫吸收,防止污染空气,即装置的作用是吸收SO2,避免污染空气;
探究2:二氧化硫能与氢氧化钙反应,故可将a、b 关闭,并将右侧导管与D相连,打开分液漏斗活塞,放入一定量且足量的石灰水,震荡,打开b,用瓶内液体总体积除以瓶子容积即为二氧化硫的体积分数。
