题目内容
 20、(1)某同学按右图装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针向
20、(1)某同学按右图装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针向(2)由质量守恒定律可知,化学反应前后,一定不变的是
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质种类.
(2)根据化学反应的实质来解释质量守恒的原因.
(2)化学反应的实质是分子破裂成原子,原子再重新组合成新的分子,所以反应前后原子的种类没有改变,原子的数目没有增减,原子的质量没有变化,元素的种类、元素的质量、物质的总质量都不变.
故答案为:(1)右;遵守;产生的二氧化碳气体逸到空气中去了
(2)①②⑤

 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案阅读下列材料,完成下列探究:
珍珠约含92%的CaCO3、4%的蛋白质(氨基酸)以及水等其他物质。以珍珠磨成的珍珠粉具有安神、美容等医用价值。央视《每周质量报告》曾揭露现今市场上存在大量以蚌壳粉冒充的珍珠粉(用氢氧化钠溶液去除蚌壳表面的有机物,用双氧水去除表面的黑色素等,然后磨成粉即可)。某研究性学习小组对本地的一种市售珍珠粉进行了以下探究。
探究一:该珍珠粉的主要成分
| 序号 | 实验内容 | 实验现象 | 实验结论 |
| ① | 取少量样品于烧杯中,滴加稀盐酸 | 有大量气泡生成 | 本格不填 |
| ② | 用铂丝蘸取①中溶液,在酒精灯上灼烧 | 火焰为砖红色 | 溶液中含有钙离子 |
| ③ | 另取少量样品于烧杯中,加水充分溶解,滴加 ▲ | 无蓝色出现 | 样品中不含有淀粉 |
| ④ | 另取少量样品于烧杯中,加水溶解,静置、过滤,在滤液中加入适量浓硝酸,加热至沸 | __ ▲ | 样品中含蛋白粉 (氨基酸) |
 (1)小名认为根据实验①、②可以推断样品中一定含有碳酸钙,小星不同意其观点。为了确认样品中含有碳酸钙,他需要补充完成的实验是(写出实验方法与现象): ▲ ;
(1)小名认为根据实验①、②可以推断样品中一定含有碳酸钙,小星不同意其观点。为了确认样品中含有碳酸钙,他需要补充完成的实验是(写出实验方法与现象): ▲ ;
(2)根据上述实验,可以判断该珍珠粉为 ▲ (填“真”或“假”)。
探究二:该珍珠粉中碳酸钙含量的测定
【方法1】小王用右图1所示装置测定该珍珠粉中碳酸钙的含量。实验方案如下:
(1)检查装置气密性:按图连接装好置后,将注射器活塞(不考虑活塞的摩擦和自重,下同)从刻度1mL处向上拉至刻度20mL处, ▲ (填操作和现象),则气密性良好。
(2)在锥形瓶内装入0.4g上述珍珠粉样品,注射器内吸入12mL的稀盐酸,再次连接装置。
(3)用力向锥形瓶内注入所有稀盐酸,并晃动锥形瓶。当没有气泡产生后,记录注射器刻度为92mL。
 (4)数据处理:该实验过程中产生CO2的体积为 ▲ mL,再根据CO2的密度(约2g/L)计算出其质量,计算出碳酸钙的质量,从而计算该珍珠粉中碳酸钙的含量。
(4)数据处理:该实验过程中产生CO2的体积为 ▲ mL,再根据CO2的密度(约2g/L)计算出其质量,计算出碳酸钙的质量,从而计算该珍珠粉中碳酸钙的含量。
【方法2】同组的小明同学另外设计了一套装置,如右图2。实验方案如下:
(1)检查装置气密性;
(2)在右图Y形装置左管内装入1.1g上述珍珠粉样品,右管内倒入一定量的稀盐酸,针筒(规格为250mL)活塞推到底部,再次连接装置。
(3)设法使左右两管内的药品混合,反应结束后读取针筒读数为220mL。
(4)数据处理:请计算该珍珠粉中碳酸钙的质量分数。(写出计算过程,最终结果保留小数点后1位。4分)
▲
【实验反思】
(1)考虑针筒的因素,上述两个实验方案对珍珠粉的用量多少必须作要求吗?为什么?
▲ 。
(2)【方法2】中第(3)步如何实现两种药品的混合? ▲ 。
(3)小明设计的装置与小王比,有何优点? ▲ (写出1点即可)。
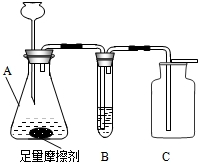 某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨: 某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
 (2008?湛江)某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨:
(2008?湛江)某品牌牙膏是由多种无机物和有机物组成的,它包括摩擦剂、洗涤泡沫剂、粘合剂、保湿剂、甜味剂、芳香剂和水分.其中摩擦剂用量达45%,该物质难溶于水,是初中常见的一种化学物质.某校化学兴趣小组利用初中知识对该牙膏的酸碱性和摩擦剂成分进行了研究探讨: