题目内容
【题目】(6分)水是人类生活中不可缺少的物质。
(1)下列净水方法中,通常用于除去水中难溶性杂质的是 ① ,净水程度最高的是 ② 。
A.过滤 B.煮沸 C.蒸馏 D.吸附
(2)自来水厂常用二氧化氯(ClO2)消毒,其中氯元素的化合价为 。
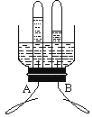
(3)小花同学设计了电解水简易装置,其中A、B电极由金属曲别针制成。
通电后的现象如图所示,则A是 ① 极。电解水的化学方程式为 ② 。
(4)自来水中含有少量Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2发生分解反应,生成难溶性的碳酸钙、水和二氧化碳,这就是壶中出现水垢的原因之一。请写出Ca(HCO3)2受热分解的化学方程式 。
【答案】(1)①A(或过滤),②C(或蒸馏)。
(2)+ 4 。
(3)①正 ②2H2O![]() 2H2↑+ O2↑。
2H2↑+ O2↑。
(4)Ca(HCO3)2![]() CaCO3↓+ H2O + CO2↑。
CaCO3↓+ H2O + CO2↑。
【解析】
试题分析:①过滤可除掉水中的难容杂质,煮沸可除掉部分可溶性钙、镁化合物,降低水的硬度,蒸馏可得到蒸馏水,是纯净物,所以蒸馏的净化程度最高
(2)化合物中各元素正负化合价的代数和为零,设氯的化合价为x,则x+(-2)×2=0,所以氯的化合价为+4。
(3)电解水时负极气体是正极气体体积的2倍,所以A是正极,水在通电条件下生成氢气和氧气。
(4)碳酸氢钙在加热的条件下分解生成碳酸钙、二氧化碳、水

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目