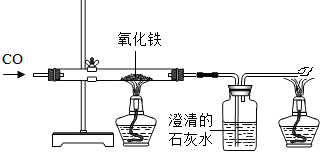
题目内容
钢铁是重要的金属材料,在生产、生活中有广泛的用途.(1)钢铁属于 (填“纯净物”或“混合物”);
(2)科学家已冶炼出了纯度高达99.9999%的铁,估计它不会具有的性质是 .
A.硬度比生铁高 B.在潮湿的空气中放置不生锈
C.能与硫酸铜反应 D.能与稀盐酸反应
(3)将一定量的铁跟过量稀硫酸反应,实验现象为 ,化学方程式为 ,反应后的溶液中溶质为 (填化学式).
(4)若要验证铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的一种是溶液 (请填溶质的名称).
【答案】分析:(1)依据钢铁都是铁的合金分析判断;
(2)依据合金的性质以及铁的化学性质分析解决;
(3)依据铁与硫酸反应会生成硫酸亚铁对问题进行分析解决;
(4)依据活动性强的金属能把活动性比它弱的金属从其盐溶液中置换出来的规律分析探讨;
解答:解:(1)钢铁都是铁的合金,其主要成分是铁,所以钢铁属于混合物;
(2)A、生铁是铁的合金所以其硬度应该大于纯度高达99.9999%的铁;
B、纯度高达99.9999%的铁也具备铁的化学性质,所以在水及氧气(潮湿的空气中存在这两种物质)共存的情况下也会生锈;
C、铁的活动性比铜强,所以能与硫酸铜反应置换出硫酸铜中的铜;
D、铁的活动性在氢前,所以能与稀盐酸反应生成氯化亚铁和氢气;
(3)铁与硫酸反应会生成硫酸亚铁和氢气,硫酸亚铁的溶液呈浅绿色,其方程式为:Fe+H2SO4=FeSO4+H2↑,由于硫酸过量所以反应后溶液中的溶质含有FeSO4、H2SO4两种.
(4)因为活动性强的金属能把活动性比它弱的金属从其盐溶液中置换出来,所以把打磨过的铁丝伸入到铝的盐溶液中,铁丝没有变化则说明铝的活动性比铁强.
故答案为:(1)混合;(2)AB;(3)溶液变为浅绿色并伴有气泡产生;(4)硫酸铝等(合理即可)
点评:此题是有关钢铁知识的考查题,解题的关键是掌握铁以及铁的合金的性质,并利用金属活动性判断金属的活动性强弱;
(2)依据合金的性质以及铁的化学性质分析解决;
(3)依据铁与硫酸反应会生成硫酸亚铁对问题进行分析解决;
(4)依据活动性强的金属能把活动性比它弱的金属从其盐溶液中置换出来的规律分析探讨;
解答:解:(1)钢铁都是铁的合金,其主要成分是铁,所以钢铁属于混合物;
(2)A、生铁是铁的合金所以其硬度应该大于纯度高达99.9999%的铁;
B、纯度高达99.9999%的铁也具备铁的化学性质,所以在水及氧气(潮湿的空气中存在这两种物质)共存的情况下也会生锈;
C、铁的活动性比铜强,所以能与硫酸铜反应置换出硫酸铜中的铜;
D、铁的活动性在氢前,所以能与稀盐酸反应生成氯化亚铁和氢气;
(3)铁与硫酸反应会生成硫酸亚铁和氢气,硫酸亚铁的溶液呈浅绿色,其方程式为:Fe+H2SO4=FeSO4+H2↑,由于硫酸过量所以反应后溶液中的溶质含有FeSO4、H2SO4两种.
(4)因为活动性强的金属能把活动性比它弱的金属从其盐溶液中置换出来,所以把打磨过的铁丝伸入到铝的盐溶液中,铁丝没有变化则说明铝的活动性比铁强.
故答案为:(1)混合;(2)AB;(3)溶液变为浅绿色并伴有气泡产生;(4)硫酸铝等(合理即可)
点评:此题是有关钢铁知识的考查题,解题的关键是掌握铁以及铁的合金的性质,并利用金属活动性判断金属的活动性强弱;

练习册系列答案
相关题目

 钢铁是重要的金属材料,在建造淮安涟水飞机场时就是用了大量的钢铁.
钢铁是重要的金属材料,在建造淮安涟水飞机场时就是用了大量的钢铁.