题目内容
一定质量的镁和碳酸镁混合物,经高温煅烧,直到质量不再变化为止。发现反应前后总质量不变,求原混合物中镁粉的质量分数
44%
本题考查的是根据化学反应方程式的计算。镁和氧气点燃生成氧化镁,产物中增加了氧气的质量,碳酸镁高温生成氧化镁和二氧化碳,产物中减少了二氧化碳的质量。但灼烧后的产物与原混合物的质量相等,说明增加的氧气与减少的二氧化碳的质量相等。我们可以设氧气和二氧化碳的质量为一个定值,根据氧气的质量求出镁的质量,再根据二氧化碳的质量求出碳酸镁的质量,最后用 ×100%,求出原混合物中金属镁的质量分数。
×100%,求出原混合物中金属镁的质量分数。
设氧气和二氧化碳的质量都为ag,镁的质量为x,碳酸镁的质量为y
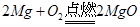
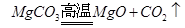
48 32 84 44
x ag y ag
48:x = 32:ag 84:y =44:ag
x=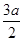 g y=
g y=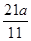 g
g
原混合物中金属镁的质量分数=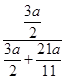 ×100%=44%
×100%=44%
 ×100%,求出原混合物中金属镁的质量分数。
×100%,求出原混合物中金属镁的质量分数。设氧气和二氧化碳的质量都为ag,镁的质量为x,碳酸镁的质量为y
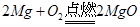
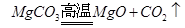
48 32 84 44
x ag y ag
48:x = 32:ag 84:y =44:ag
x=
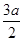 g y=
g y=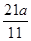 g
g原混合物中金属镁的质量分数=
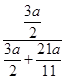 ×100%=44%
×100%=44%
练习册系列答案
相关题目