题目内容
经测定,甲醛(CH2O)、醋酸(C2H4O2)、丙酮(C3H6O)三种物质的混合物中含氢元素8g,则该混合物完全燃烧后产生二氧化碳气体的质量是
| A.48g | B.72g | C.120g | D.176g |
D
试题分析:由甲醛、醋酸和丙酮的化学式可知,每个分子中的C、H原子个数比均为1:2,则C、H元素质量比均等于(1×12):(2×1)=6:1;根据题意,混合物中含氢元素8g,则混合物中含碳元素的质量为8g×6=48g;根据质量守恒定律可知,混合物中所含有的碳元素的质量=完全燃烧后产生的二氧化碳气体中碳元素的质量。再结合“物质的质量=物质中某元素的质量÷该元素的质量分数”可知,燃烧后产生的二氧化碳气体的质量=48g÷
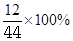 =176g。故选D
=176g。故选D点评:本题主要考查有关化学式的计算,熟练掌握相关计算的方法,是解题的关键,此外还应注意元素守恒思想在解题中的重要作用。

练习册系列答案
相关题目
 )与乙(
)与乙( )反应生成丙(
)反应生成丙(
 )的微粒
)的微粒 数变化示意图,则下列说法正确的是
数变化示意图,则下列说法正确的是
 (1)图A方框的横线上填的是 ,图B方框的横线上的数学是 。
(1)图A方框的横线上填的是 ,图B方框的横线上的数学是 。
