题目内容
某校兴趣小组同学为探究铁的化学性质,如图进行了以下三个实验,请回答有关问题: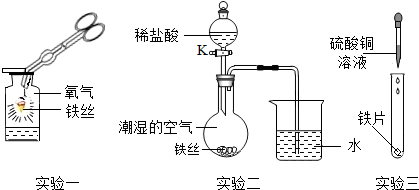
(1)实验一:所发生反应的化学方程式是______,实验结束后可能产生的不良后果是______;
(2)实验二:关闭K一段时间后,观察到导管内液面上升;打开K,滴加稀盐酸,观察到导管内液面下降,导管口有气泡冒出,关闭K,导管内液面上升的原因是______;导管内液面下降的原因是______.(用化学方程式解释).
(3)实验三:实验观察到的现象是:______,这一现象说明______(填“铁”或“铜”)的活动性更强.

(1)实验一:所发生反应的化学方程式是______,实验结束后可能产生的不良后果是______;
(2)实验二:关闭K一段时间后,观察到导管内液面上升;打开K,滴加稀盐酸,观察到导管内液面下降,导管口有气泡冒出,关闭K,导管内液面上升的原因是______;导管内液面下降的原因是______.(用化学方程式解释).
(3)实验三:实验观察到的现象是:______,这一现象说明______(填“铁”或“铜”)的活动性更强.
(1)铁在氧气中燃烧生成黑色固体四氧化三铁,反应的化学方程式为:3Fe+2O2
Fe3O4;集气瓶底预先铺上一层细沙或少量的水,防止生成物落下来炸裂集气瓶;
(2)铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;盐酸和铁反应生成氢气,所以使瓶内压强变大,观察到导管内液面下降,导管口有气泡冒出,化学方程式为Fe+2HCl=FeCl2+H2↑.故填:铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;Fe+2HCl=FeCl2+H2↑.
(3)铁能与硫酸铜发生置换反应生成硫酸亚铁和铜,硫酸亚铁的水溶液为浅绿色,铜为红色.故:实验三:实验观察到的现象是:有红色固体析出,蓝色溶液变浅绿色,这一现象说明 铁的活动性更强.
故答案为:(1)3Fe+2O2
Fe3O4;集气瓶破裂
(2)铁生锈消耗了瓶内的氧气,瓶内气压小于外界大气压,液面上升;Fe+2HCl=FeCl2+H2↑
(3)有红色固体析出,蓝色溶液变浅绿色;铁
| ||
(2)铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;盐酸和铁反应生成氢气,所以使瓶内压强变大,观察到导管内液面下降,导管口有气泡冒出,化学方程式为Fe+2HCl=FeCl2+H2↑.故填:铁在潮湿的空气易生锈,消耗空气中的氧气,使瓶内压强减小,所以观察到导管内液面上升;Fe+2HCl=FeCl2+H2↑.
(3)铁能与硫酸铜发生置换反应生成硫酸亚铁和铜,硫酸亚铁的水溶液为浅绿色,铜为红色.故:实验三:实验观察到的现象是:有红色固体析出,蓝色溶液变浅绿色,这一现象说明 铁的活动性更强.
故答案为:(1)3Fe+2O2
| ||
(2)铁生锈消耗了瓶内的氧气,瓶内气压小于外界大气压,液面上升;Fe+2HCl=FeCl2+H2↑
(3)有红色固体析出,蓝色溶液变浅绿色;铁

练习册系列答案
相关题目
 黄金做饰品
黄金做饰品

