题目内容
【题目】空气是一种重要资源:
(一)防治空气污染、改善生态环境已成为全民共识。近年来,一些城市空气中出现可吸入悬浮颗粒物与雾形成“雾霾”天气。粒径不大于 2.5μm 的可吸入悬浮颗粒物(PM2.5) 富含大量有毒、有害物质。
(1)下列行为可能会导致“雾霾”加重的是__________(填标号)。
a.燃煤脱硫 b.植树造林 c.静电除尘 d.燃放鞭炮
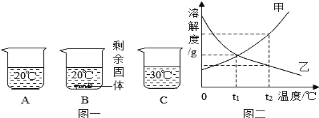
(2)为了减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx 及 CxHy 的排放意义重大。机动车尾气污染物的含量与“空/燃比”(空气与燃油气的体积比)的变化关系如图所示。
①利用氨气可将汽车尾气中的氮氧化物 (NOx)在一定条件下转化未对空气无污染的物质。请将该反应的化学方程式补充完整:
4xNH3+6NOx ![]() (2x+3)N2+___。
(2x+3)N2+___。
②随着空燃比增大,CO 和 CxHy 的含量减少的原因是__。
(3)CH4、乙炔 (C2H2)和丙烷 (C3H8)都能在空气中燃烧,但是仅 C2H2 燃烧时有浓烟,试从物质组成的角度分析其燃烧现象不同的原因是:___。写出丙烷在空气中完全燃烧的化学方程式_____。
(二)用如图装置测定空气中氧气的体积分数。
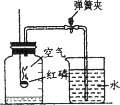
①如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。红磷燃烧的化学方程式为______。 由该实验可得出结论为:氧气约占空气总体积的______。瓶中剩余的气体主要是___。
②如果测定的结果低于该体积含量,则可能的原因是______ (填序号)。
A.红磷过量 B.装置漏气
C.实验过程中弹簧夹未夹紧,气体沿导管逸出
D.未冷却至室温就打开了弹簧夹
【答案】d 6xH2O 燃油气逐渐充分燃烧 乙炔中含碳量高 C3H8+5O2![]() 3CO2+4H2O 4P+5O2
3CO2+4H2O 4P+5O2![]() 2P2O5
2P2O5 ![]() 氮气 BD
氮气 BD
【解析】
(一)(1)a、燃煤脱硫可以减少有害物质的排放,不会加重“雾霾”,故a不符合题意;
b、植树造林会净化环境,不会加重“雾霾”,故b不符合题意;
c、静电除尘会减少颗粒物,不会加重“雾霾”,故c不符合题意;
d、燃放鞭炮会产生大量微小颗粒物,增加了空气中PM2.5的含量,会导致雾霾产生,故d符合题意。故选d。
(2)①化学反应前后原子种类和数目不变,反应物中含有4x+6个氮原子、12x个氢原子、6x个氧原子;生成物中含有4x+6个氮原子、所以还少12x个氢原子、6x个氧原子,所以后面是6x个H2O分子,故答案为:6xH2O;
②空燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少。
(3)CH4、乙炔 (C2H2)和丙烷 (C3H8)都能在空气中燃烧,但是仅 C2H2 燃烧时有浓烟,试从物质组成的角度分析其燃烧现象不同的原因是:乙炔中含碳量高。丙烷在空气中完全燃烧生成水和二氧化碳,反应的化学方程式为:C3H8+5O2![]() 3CO2+4H2O。
3CO2+4H2O。
(二)①红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2![]() 2P2O5。反应结束后,冷却、打开止水夹,水进入集气瓶,进入水的体积约为集气瓶上方容积的五分之一,由该实验可得出结论为:氧气约占空气总体积的1/5。瓶中参加反应的是氧气,剩余的气体主要是氮气。
2P2O5。反应结束后,冷却、打开止水夹,水进入集气瓶,进入水的体积约为集气瓶上方容积的五分之一,由该实验可得出结论为:氧气约占空气总体积的1/5。瓶中参加反应的是氧气,剩余的气体主要是氮气。
②A、红磷过量消耗氧气充分,结果准确,不符合题意;
B、装置漏气,使进入的水偏少,结果偏低,符合题意;
C、实验过程中弹簧夹未夹紧,气体沿导管逸出,导致气体减少的多,进入水的体积偏大,结果偏高,不符合题意;
D、未冷却至室温就打开了弹簧夹,使进入的水偏少,使结果偏低,符合题意。故选BD。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】在学校的元旦联欢会上,默默同学表演了“水能生火”的魔术。他向包有过氧化钠 (Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来。这是什么原因呢?请你和小明同学进行实验探究。
[提出问题]过氧化钠与水反应生成了什么物质?为什么脱脂棉会燃烧?
[猜想]①可能有一种气体和另种物质生成;②反应过程中可能有能量变化
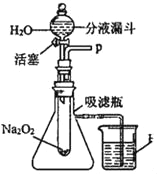
[实验探究]设计了如图所示的装置进行探究
[已知]碳酸钠同碳酸钙一样能与盐酸发生类似的化学反应。
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中分液漏斗的活塞,控制滴加水的速率,观察活塞到试管内有气泡产生,用带火星的木条靠近P处,木条复燃。说明生成的气体是_____。
(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因是:_____
实验二:探究反应后生成的另一种物质是什么?
①千贺同学猜想另一种物质可能是Na2CO3,为了证实千贺同学的猜想,请你设计一个实验:证明生成物中没有Na2CO3
实验操作 | 实验现象 | 实验结论 |
②暖心同学认为不做上述实验也可以从理论上说明千贺同学的猜想是错误的,请你说出暖心同学的理由:_____。
③飞舟同学猜想另一种生成物为氢氧化钠 (NaOH),老师告诉飞舟同学:你的猜想是正确的,请你试着写出该反应的化学方程式:_____。
【题目】实验探究是化学研究的常用手段。初中化学课上,同学们利用如图实验探究碱的化学性质

①A实验中滴加酚酞的作用是:________;
②B实验中观察到的现象为:__________;
③C实验中反应的化学方程式为:______。
【实验再探究】实验结束后,同学们将废液倒入同一只废液缸中,发现废液浑浊并显红色。
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_______。
老师问:废液中还可能含有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能含有Ca(OH)2 | 学生乙 | 可能含有Na2CO3 |
学生丙 | 可能含有CaCl2 | 学生乙 | 可能含有 ________ |
【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
【结论】上述滤液中,还含有_________,没有_____________。
【实验反思】
①根据以上B实验可知,氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:____;
②现有一瓶长期敞口放置的氢氧化钠溶液,它的变质程度如何呢?
【查阅资料】Ⅰ氯化钙溶液呈中性。
Ⅱ氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3═CaCO3↓+2NaCl
为了弄清久置的氢氧化钠是否完全变质,设计了如下方案:
实验步骤 | 实验现象 | 实验结论 |
①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡 | 有__________生成 | 说明原溶液中一定有碳酸钠 |
②取步骤①试管中的少量上层清液,滴加酚酞溶液 | 溶液变红色 | 说明原溶液中一定有____________ |
【实验结论】
该氢氧化钠溶液_______________(填“部分”或“全部”)变质。
【反思与评价】
在上述实验步骤①中,小强提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案___(填“可行”或“不可行”)。