题目内容
磁铁矿(主要成分是Fe3O4)是冶炼生铁的常用原料.若测得某磁铁矿石中铁元素的质量分数为49%.(假设杂质不含铁元素)请回答下列问题:(1)四氧化三铁中铁元素与氧元素的质量比为______;
(2)该矿石中四氧化三铁的质量分数为______;
(3)若要得到纯铁28t,从理论上计算需要这种磁铁矿石______t.
【答案】分析:(1)利用化学式和原子量及原子个数来计算元素的质量比.
(2)可利用铁的质量分数来计算,根据矿石质量×四氧化三铁的质量分数×铁元素的质量分数═矿石质量×49%.
(3)根据元素守恒,矿石中的铁元素质量等于纯铁中铁元素质量.
解答:解:(1)由Fe3O4可知铁元素与氧元素的质量比为56×3:16×4═21:8,故答案为:21:8.
(2)设矿石中四氧化三铁的质量分数为X,则:X× %═49%,解得X═67.7%,故答案为:67.7%.
%═49%,解得X═67.7%,故答案为:67.7%.
(3)设理论上计算需要这种磁铁矿石为X吨,则:X×67.7%×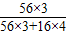 ×100%═28,解得X═57.1,故答案为:57.1.
×100%═28,解得X═57.1,故答案为:57.1.
点评:本题计算较繁杂,但计算思路很明确,利用化学式进行相关的元素质量比和质量分数的计算.
(2)可利用铁的质量分数来计算,根据矿石质量×四氧化三铁的质量分数×铁元素的质量分数═矿石质量×49%.
(3)根据元素守恒,矿石中的铁元素质量等于纯铁中铁元素质量.
解答:解:(1)由Fe3O4可知铁元素与氧元素的质量比为56×3:16×4═21:8,故答案为:21:8.
(2)设矿石中四氧化三铁的质量分数为X,则:X×
 %═49%,解得X═67.7%,故答案为:67.7%.
%═49%,解得X═67.7%,故答案为:67.7%.(3)设理论上计算需要这种磁铁矿石为X吨,则:X×67.7%×
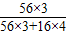 ×100%═28,解得X═57.1,故答案为:57.1.
×100%═28,解得X═57.1,故答案为:57.1.点评:本题计算较繁杂,但计算思路很明确,利用化学式进行相关的元素质量比和质量分数的计算.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
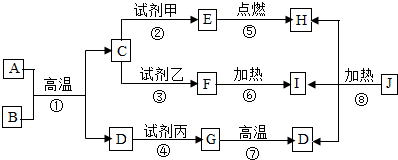
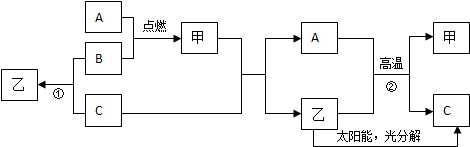

 如图中A~F及X、Y表示几种初中化学常见的物质,“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去.已知A、B组成元素相同,C是一种能供给呼吸的气体,D是一种黑色固体,是磁铁矿的主要成分,E、F是组成元素相同的气体氧化物,X是一种非金属固体单质,Y是金属单质,试回答:
如图中A~F及X、Y表示几种初中化学常见的物质,“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去.已知A、B组成元素相同,C是一种能供给呼吸的气体,D是一种黑色固体,是磁铁矿的主要成分,E、F是组成元素相同的气体氧化物,X是一种非金属固体单质,Y是金属单质,试回答: