题目内容
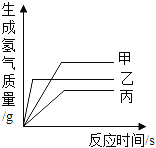
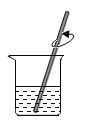
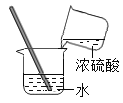
【题目】某学习小组想用锌和稀硫酸反应制取氢气,他们按照如图所示操作对浓硫酸进行稀释。某同学提出锌和浓硫酸是否也能产生氢气呢?于是他将少量浓硫酸加入到盛有锌粒的试管中,发现生成的气体具有刺激性气味。同学们对产生的气体很感兴趣,于是进行了探究。
(猜想与假设)
气体是:①H2 ②SO2 ③H2和SO2
同学们经过讨论,便直接否定了猜想①,原因是_______
(查阅资料)
(1)浓硫酸具有强氧化性,它与一些金属单质反应会产生二氧化硫气体
(2)二氧化硫能使红色品红溶液褪色
(3)氢气具有还原性
(进行实验)
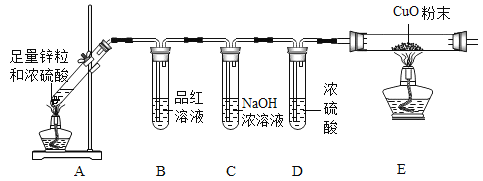
(解释与结论)
(1)同学们稀释浓硫酸时,玻璃棒的作用是_______。
(2)写出锌与稀硫酸反应的化学方程式_______。
(3)装置中氢氧化钠浓溶液的作用是_______。
(4)通过此实验,同学们证明了猜想③正确,请写出他们依据的实验现象_____。
(反思与评价)
经过讨论,小组中某个同学认为上述实验有不妥之处,他将上述实验进行改进,将足量锌粒换成少量锌粒,重复实验,得出猜想②正确。
(5)补全锌和浓硫酸反应的化学方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+______
(6)请解释第一次实验中得到氢气的原因________
【答案】氢气没有刺激性气味 搅拌散热 Zn+H2SO4=ZnSO4+H2↑ 吸收二氧化硫 B中品红褪色,E中黑色固体变成红色,右侧导管口有无色液滴 2H2O 随着浓硫酸的消耗和水的生成,硫酸浓度变低,遇足量的锌产生氢气
【解析】
猜想与假设:同学们经过讨论,便直接否定了猜想①,原因是:氢气是无色无味的气体,而产生的气体有刺激性气味;
解释与结论:
(1)同学们稀释浓硫酸时,玻璃棒的作用是:搅拌、散热,防止液体飞溅;
(2)锌与稀硫酸反应产生硫酸锌和氢气的化学方程式:Zn+H2SO4=ZnSO4+H2↑;
(3)装置中氢氧化钠浓溶液显碱性,能与二氧化硫有毒气体反应生成亚硫酸钠和水,作用是:吸收二氧化硫气体;
(4)通过此实验,同学们证明了猜想③正确,气体中同时含氢气和二氧化硫,二氧化硫能使红色品红溶液褪色,所以B中品红褪色,氢气具有还原性,且燃烧产生水,所以装置E中黑色固体变成红色,右侧导管口有无色液滴。
(5)该反应符合质量守恒定律:反应物比生成物多4个氢原子和2个氧原子,锌与浓硫酸反应产生硫酸锌、二氧化硫和水的化学方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O。
(6)第一次实验中得到氢气的原因:随着浓硫酸的消耗和水的生成,硫酸浓度逐渐变低(相当于稀硫酸),稀硫酸遇足量的锌产生氢气。

【题目】阅读下面的科普短文。
中国有很长的饮茶历史,茶叶中含有茶多酚等物质。
茶多酚是从天然茶叶中提取的混合物,由儿茶素、黄酮苷类、酚酸等组成,是一种白色粉末,略有吸水性。易溶于温水、乙醇等,在碱性环境中不稳定。茶多酚容易被氧化变色,下图是多酚氧化酶催化茶多酚氧化的示意图(图中a、b、c、d分别代表4种物质)。

研究发现,茶多酚是茶叶发挥健康保健功效最主要的物质,最典型的代表是儿茶素,具有抗氧化(消除氧自由基)、抗炎、降低心血管病发病几率、预防癌症、降血脂、减少体脂形成、抗菌、改变肠道菌群生态等多项功效。研究表明,喝下一杯茶半小时后,血中的抗氧化容量(对抗氧自由基的能力)增加41%﹣48%,并能在高水平状态持续一个半小时。
茶多酚还可用于食品保鲜防腐,根据我国《食品添加剂使用卫生标准》规定茶多酚的使用范围和使用量如下:
食物 | 不含水的脂肪和油 | 熟坚果 | 油炸面制品 | 燕麦片 | 方便面 |
含量(g/kg) | 0.4 | 0.2 | 0.2 | 0.2 | 0.2 |
溶剂法是从茶叶中提取茶多酚的传统方法之一,利用茶多酚和茶叶中其他成分在乙醇中的溶解度不同进行分离。具体的方法是将茶叶用乙醇浸渍,然后把浸取液进行液﹣液分离,最后浓缩得到产品。
依据文章内容回答下列问题。
(1)根据以上描述请你归纳茶多酚的物理性质有_________________。
(2)多酚氧化酶催化茶多酚氧化的过程中,其中代表酶的是_________________
A a B b C c D d
(3)若一包方便面的质量是100g,则最多加入茶多酚保鲜剂_________________mg。
(4)下列关于茶多酚的说法中,正确的是_________________
A 茶多酚在碱性环境中不稳定
B 适量喝茶有益身体健康
C 利用溶剂法提取茶多酚属于化学变化
D 某同学在中午12点喝了一杯茶,他血中的抗氧化容量的较高水平可持续到14点
(5)保存茶多酚晶体时应注意_________________。