题目内容
X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验;已知金属氧化物与盐酸反应生成氯化物和水;C是两种金属单质的混合物。
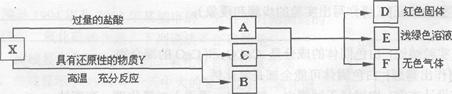
(1)x中含有的金属元素是 ______,F是__________。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。

(1)x中含有的金属元素是 ______,F是__________。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
(1)Fe和Cu(或铁和铜), 氢气或H2
(2)CuO+2HCl=CuCl2+H20或Fe203+6HCl=2FeCl3+3H20
或Fe0+2HCl=FeCl2+H20等
(3)C+2CuO 高温2Cu+C02或2Fe203+3C高温4Fe+3C02 等;H2 、CO
(2)CuO+2HCl=CuCl2+H20或Fe203+6HCl=2FeCl3+3H20
或Fe0+2HCl=FeCl2+H20等
(3)C+2CuO 高温2Cu+C02或2Fe203+3C高温4Fe+3C02 等;H2 、CO
试题分析:(1)根据题意,X是两种金属氧化物组成的混合物,与过量的盐酸反应,所得的A中含有生成的盐溶液和剩余的盐酸;另外,金属氧化物能被还原性物质还原,生成相应的金属;得到的C与A混合,生成了浅绿色的溶液的E,故E为氯化亚铁,则C中含有铁;反应后得到的D是红色固体,则D可能是铜;由于铁能与盐酸反应生成氢气,故F可能是氢气,所以X中含有的金属元素是铁元素和铜元素。
(2)根据上面的推断可知,X中可能含有氧化铜和氧化铁,其中氧化铜能与盐酸反应生成氯化铜和水,故反应的化学方程式为CuO+2HCl═CuCl2+H2O;氧化铁能与盐酸反应生成氯化铁和水,故反应的化学方程式为Fe203+6HCl=2FeCl3+3H20。
(3)由于Y为还原性物质,故若Y为固体,则Y为碳,能与氧化铜反应生成铜和二氧化碳,故反应的化学方程式为C+2CuO
 2Cu+C02;能与氧化铁反应生成铁和二氧化碳,故反应的化学方程式为2Fe203+3C
2Cu+C02;能与氧化铁反应生成铁和二氧化碳,故反应的化学方程式为2Fe203+3C 4Fe+3C02;若Y为气体,则Y还可以是H2或CO。
4Fe+3C02;若Y为气体,则Y还可以是H2或CO。点评:此题为框图式推断题,解答此类题的关键是找准解题突破口,即找出有特殊性质的物质或特殊现象的反应,再根据叙述的关键,以及物质的性质和物质之间的反应,做出判断。

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
 CO + H2,C + O2
CO + H2,C + O2