题目内容
(2011?营口)你只要观察一下周围,就会发现我们的生活离不开金属.请根据你对金属和金属材料的认识,回答下面的问题:
(1)常见的铁合金包括
(2)铬是重要的金属材料,将一片用砂纸打磨过的铬片放入稀硫酸中,发现其表面缓慢产生气泡,由此可以推断金属铬与硫酸铜溶液
(3)与金属的活动性顺序类似,有些非金属单质与盐反应也有相应的规律.根据以下两个反应:Cl2+2NaBr═2NaCl+Br2、Br2+2NaI═2NaBr+I2判断Cl2、Br2、I2的活泼性由弱到强的顺序是
(1)常见的铁合金包括
生铁
生铁
和钢
钢
,它们性能不同的原因是含碳量不同
含碳量不同
;(2)铬是重要的金属材料,将一片用砂纸打磨过的铬片放入稀硫酸中,发现其表面缓慢产生气泡,由此可以推断金属铬与硫酸铜溶液
能
能
(填“能”或“不能”)反应;(3)与金属的活动性顺序类似,有些非金属单质与盐反应也有相应的规律.根据以下两个反应:Cl2+2NaBr═2NaCl+Br2、Br2+2NaI═2NaBr+I2判断Cl2、Br2、I2的活泼性由弱到强的顺序是
I2<Br2<Cl2
I2<Br2<Cl2
.分析:根据已有的知识进行分析,生铁和钢的区别是含碳量不同,含碳量不同导致机械性能不同,在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:(1)铁的合金为生铁和钢,含碳量不同而导致机械性能不同,所以本题答案为:生铁,钢,含碳量不同;
(2)铬能与硫酸反应生成氢气,说明铬在氢前,而铜在氢后,故铬能与硫酸铜溶液反应,所以本题答案为:能;
(3)氯气能与溴化钠反应生成溴单质,说明Cl2>Br2,溴单质能与碘化钠反应生成碘单质,说明Br2>I2,所以Cl2、Br2、I2的活泼性由弱到强的顺序是I2<Br2<Cl2,所以本题答案为:I2<Br2<Cl2.
(2)铬能与硫酸反应生成氢气,说明铬在氢前,而铜在氢后,故铬能与硫酸铜溶液反应,所以本题答案为:能;
(3)氯气能与溴化钠反应生成溴单质,说明Cl2>Br2,溴单质能与碘化钠反应生成碘单质,说明Br2>I2,所以Cl2、Br2、I2的活泼性由弱到强的顺序是I2<Br2<Cl2,所以本题答案为:I2<Br2<Cl2.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
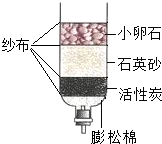 (2011?营口)今年春季我国西南地区遭遇大范围持续干旱,为缓解旱情,政府组织实施了多次人工降雨,全国人民团结一致共同抗旱.
(2011?营口)今年春季我国西南地区遭遇大范围持续干旱,为缓解旱情,政府组织实施了多次人工降雨,全国人民团结一致共同抗旱.