题目内容
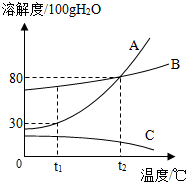 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:(1)t2℃时A、B、C三种物质的溶解度由大到小的顺序是
(2)若要将C的饱和的溶液变为不饱和溶液且不改变溶液溶质质量分数,采用的方法是
(3)将t2℃时A、B、C三种物质饱和溶液的温度降低到t1℃时,三种溶液的溶质质量分数由大小关系是
(4)t1℃时30gA物质加入到50g水中不断搅拌形成的溶液质量是
(5)在含有少量的B的A中分离出 A,可采用
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,饱和溶液和不饱和溶液相互转变的方法,溶质的质量分数、溶解性和溶解度的关系
专题:溶液、浊液与溶解度
分析:(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)饱和溶液变为不饱和溶液的一般方法是:加入溶剂、升温,并结合C的溶解度随温度变化分析解答;
(3)据饱和溶液中溶质的质量分数计算方法及物质的溶解度受温度影响情况分析解答;
(4)据该温度下A的溶解度及溶质的质量分数计算方法分析解答;
(5)据物质的溶解度受温度影响情况分析提纯物质的方法.
(2)饱和溶液变为不饱和溶液的一般方法是:加入溶剂、升温,并结合C的溶解度随温度变化分析解答;
(3)据饱和溶液中溶质的质量分数计算方法及物质的溶解度受温度影响情况分析解答;
(4)据该温度下A的溶解度及溶质的质量分数计算方法分析解答;
(5)据物质的溶解度受温度影响情况分析提纯物质的方法.
解答:解:(1)t2℃时A、B、C三种物质的溶解度由大到小的顺序是A=B>C;
(2)若要将C的饱和的溶液变为不饱和溶液且不改变溶液溶质质量分数,则不能采取加入溶剂的方法,因为加入水会导致溶质的质量分数减小;C的溶解度随温度升高而减小,所以可采取降温的使其变为饱和溶液,因为降温溶质、溶剂的质量均不变,溶质的质量分数不变;
(3)AB的溶解度随温度降低而减小,C的溶解度随温度降低而增大,所以将t2℃时A、B、C三种物质饱和溶液的温度降低到t1℃时,AB析出晶体,C无溶质析出,溶质的质量分数与降温前相等,据饱和溶液中质量分数的计算式
×100%可知:溶解度越大质量分数也就越大,而t1℃时B的溶解度大于A的溶解度大于t2℃时C的溶解度,所以三种溶液的溶质质量分数由大小关系是B>A>C;
(4)t1℃时A的溶解度是30g,即100g水中最多溶解30g的A,所以30gA物质加入到50g水中不断搅拌最多溶解15g,形成的溶液质量是65g;继续升温到t2℃时,溶解度变为80g,剩余的固体可全部溶解,所得溶液的溶质质量分数是
×100%=37.5%;
(5)由图可知:A的溶解度受温度影响比B大,所以在含有少量的B的A中分离出 A,可采用冷却热饱和溶液或降温结晶的方法;
故答案为:
(1)A=B>C;(2)降温;(3)B>A>C;(4)65;37.5%; (5)冷却热饱和溶液(或降温结晶).
(2)若要将C的饱和的溶液变为不饱和溶液且不改变溶液溶质质量分数,则不能采取加入溶剂的方法,因为加入水会导致溶质的质量分数减小;C的溶解度随温度升高而减小,所以可采取降温的使其变为饱和溶液,因为降温溶质、溶剂的质量均不变,溶质的质量分数不变;
(3)AB的溶解度随温度降低而减小,C的溶解度随温度降低而增大,所以将t2℃时A、B、C三种物质饱和溶液的温度降低到t1℃时,AB析出晶体,C无溶质析出,溶质的质量分数与降温前相等,据饱和溶液中质量分数的计算式
| 溶解度 |
| 溶解度+100g |
(4)t1℃时A的溶解度是30g,即100g水中最多溶解30g的A,所以30gA物质加入到50g水中不断搅拌最多溶解15g,形成的溶液质量是65g;继续升温到t2℃时,溶解度变为80g,剩余的固体可全部溶解,所得溶液的溶质质量分数是
| 30g |
| 30g+50g |
(5)由图可知:A的溶解度受温度影响比B大,所以在含有少量的B的A中分离出 A,可采用冷却热饱和溶液或降温结晶的方法;
故答案为:
(1)A=B>C;(2)降温;(3)B>A>C;(4)65;37.5%; (5)冷却热饱和溶液(或降温结晶).
点评:了解溶解度概念、溶质质量分数的计算方法、溶解度曲线的意义,才能正确解答,考查比较全面.

练习册系列答案
相关题目
小唐同学用98%的浓硫酸配制一定质量的10%的稀硫酸,在用量筒量取浓硫酸时,不恰当地俯视了读数.其他步骤均正确.他配制的稀硫酸的溶质质量分数( )
| A、偏高 | B、偏低 |
| C、准确 | D、都有可能 |
除去下列物质括号中含有的杂质,所选试剂错误的是( )
| A、铁粉(氧化铁)…稀硫酸 |
| B、硝酸钠(氯化钠) …硝酸银 |
| C、CO(CO2) …氢氧化钠 |
| D、氯化铜(硫酸铜) …氯化钡 |
在Na2S、Na2SO3、Na2SO4的混合物中,测得氧元素的质量分数为22%,则混合物中钠元素的质量分数为( )
| A、39.9% | B、46% |
| C、23% | D、78% |

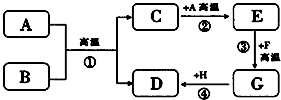 A~H都是初中化学常见的物质,它们的转化关系如图所示.A、B均为黑色粉末;D、F均为红色固体,且D为单质;C能使澄清石灰水变浑浊.请回答:
A~H都是初中化学常见的物质,它们的转化关系如图所示.A、B均为黑色粉末;D、F均为红色固体,且D为单质;C能使澄清石灰水变浑浊.请回答: