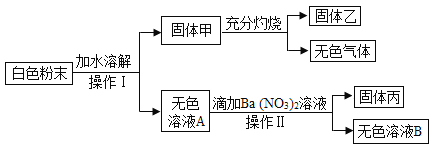
题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
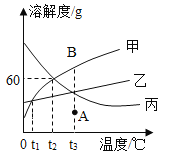
(1) t3℃时,三种物质中溶解度最大的是_____________ 。
(2) t2℃时,在盛有 50g 水的烧杯中加入 35g 甲物质,充分搅拌后所得溶液的质量是 _____________g。
(3)若甲的饱和溶液中含有少量物质乙,提纯甲的方法是_____________________。
(4)将 t2℃的甲、乙、丙三种物质的饱和溶液降温到 t1℃时,所得溶液中溶质的质量分数关系为 _____________(用“=”“<”或“>”符号连接)。
【答案】甲 80g 降温结晶法 丙>甲=乙
【解析】
(1) 分析三种物质的溶解度曲线图,t3℃时,溶解度最大的是甲。
(2) t2℃时,甲的溶解度是60g,也就是100g水最多溶解60g甲,则在盛有 50g 水的烧杯中加入 35g 甲物质,充分搅拌后只能溶解30g,所得溶液的质量是50g+ 30g =80g。
(3)甲的溶解度随温度变化比较大,乙的溶解度随温度变化比较小,若甲的饱和溶液中含有少量物质乙,提纯甲的方法是降温结晶法。
(4) t2℃时甲、乙、丙三种物质的饱和溶液的溶质质量分数是甲=丙>乙,将温度从 t2℃降到 t1℃时,丙的饱和溶液变为不饱和溶液,溶质质量和溶剂质量不变,溶质质量分数不变,而甲乙两物质析出晶体,溶解度变小,溶质质量分数变小,且曲线形成交点,所以甲乙两物质的溶质质量分数相等,因此,所得溶液中溶质的质量分数关系为丙>甲=乙。

 阅读快车系列答案
阅读快车系列答案【题目】同学们知道铁的化学性质比较活泼,能与氧气、酸、CuSO4溶液等多种物质发生化学反应。化学兴趣小组在课外资料中发现,铁和Fe2O3竟然也能发生化学反应。
(提出问题)铁和Fe2O3反应的产物是什么?
(查阅资料)①在FeO、Fe2O3、Fe3O4中,Fe2O3是红棕色,其余都是黑色;FeO在空气中会很快被氧化成Fe2O3;只有Fe3O4有磁性。②二氧化碳可用作该反应的保护气。③铁的氧化物都能与酸溶液反应。
(猜想与假设)根据质量守恒定律,请你猜想铁和Fe2O3反应的产物:
①只有FeO;②只有Fe3O4;③_____。
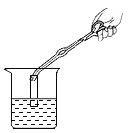
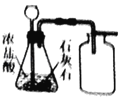
(进行实验)(1)按下图装好药品(铁粉过量),连好仪器(装入药品前已检查装置的气密性)。
(2)轻推注射器活塞通入二氧化碳,估计玻璃管里空气_____,停止通入二氧化碳。
(3)点燃酒精喷灯加热药品,等到固体粉末全部变黑,再熄灭酒精喷灯。
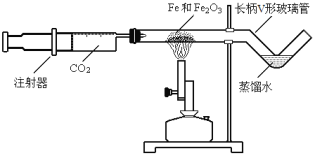
(4)当长柄V形玻璃管冷却至室温时,检验黑色粉末成分。检验过程如下:
检验操作及现象 | 检验结果 | |
a | 黑色粉末暴露在空气中不变色 | 黑色粉末中一定没有_____ |
b | 用磁铁靠近,黑色粉末能完全被吸引。 | 黑色粉末中一定含有铁和_____ |
c | 取少量的黑色粉末装入试管,滴加足量的_____溶液,出现红色固体,充分反应后仍残留少许黑色粉末。 | 确认猜想_____正确 |
(探究结论)铁和Fe2O3能发生化合反应,有关的化学方程式是_____。
(反思评价)(1)实验结束,向V形管中的液体里滴入石蕊试液,变为_____色。接下来,再微热V形管中的液体,发生反应的化学方程式是_____。
(2)本实验中的保护气,既能用二氧化碳气体,也能用_____。