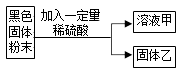
题目内容
【题目】金属钠投入到NH4Cl溶液中,钠浮在液面上,熔成小球,四处游动,并生成大量气体。为确定气体的成分,进行下列实验探究.
(1)猜想:气体可能是HCl、NH3、H2中的一种或几种,作此猜想的理论依据是。
(2)实验:甲同学为判断气体成分,查阅资料得知:2NH3+3CuO ![]() 3Cu+N2+3H2O。于是设计了如图实验装置:
3Cu+N2+3H2O。于是设计了如图实验装置:
现象与结论:A中观察到酚酞试剂变为红色,证明有;B中玻璃管内观察到固体表面由黑色变红色,证明有。
(3)实验反思:
①浓硫酸的作用是。
②乙同学认为甲的设计不能确定是否含有HCl,于是他将气体通入混有稀硝酸的溶液中,无白色沉淀产生,则该气体中 HCl(填“有”或“无”)。
③请完善Na与NH4Cl溶液反应的化学方程式2Na+2NH4Cl=2NH3↑+H2↑+2。
(4)已知2.3g的钠与一定量的溶质质量分数为10%的氯化铵溶液正好完全反应,求反应后所得氨气的质量是多少?
【答案】
(1)化学反应前后元素种类保持不变
(2)NH3,H2
(3)吸收氨气和水,硝酸银,无,NaCl
(4)1.7g
【解析】(1). 化学反应前后元素种类保持不变 ,NH4Cl由氯、氮、氢三种元素组成, HCl、NH3、H2的组成元素复合,且都是气体; (2) NH3 和水反应生成氨水,溶液呈碱性,使酚酞试液变红;A中观察到酚酞试剂变为红色,证明有氨气; . 氨气易溶于水,能与硫酸反应,所以气体通入B之前氨气被除尽,则B中玻璃管内观察到固体表面由黑色变红色,证明有还原性气体H2 (3). ①硫酸和氨气反应生成硫酸铵,而吸收氨气,同时浓硫酸是干燥剂,可以吸收吸收气体中的水 ②硝酸银能和盐酸反应生成氯化银白色沉淀,将气体通入混有稀硝酸的硝酸银溶液中,无白色沉淀产生,则该气体中无HCl ;③ 据质量守恒定律可知,反应前后原子的种类、个数不变,因此化学式为 NaCl ;(4) 依据化学方程式的计算即可得到;
所以答案是:化学反应前后元素种类保持不变、NH3、H2、吸收氨气和水、硝酸银、无、NaCl、
解:设氨气的质量为x,则
2Na + 2NH4Cl = | 2NH3↑+H2↑+2 NaCl |
46 | 34 |
2.3g | x |
![]()
X=1.7g
答:略

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】小明同学查阅资料时,发现高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。他很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
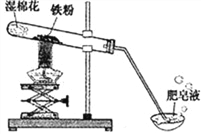
【实验探究1】如右图
(1)用燃着的木条靠近肥皂泡,有爆鸣声。
(2)稍后看到有肥皂泡飘到空中的现象。
【实验结论】
根据(1)(2)推理生成的气体是______ 。
【思考】
小明同学欣喜异常,立即开始探究试管中剩余固体成分。
【查阅资料】
相关物质化学式 | Fe | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 能 | 否 | 否 | 能 |
【实验探究2】观察试管中剩余固体的为黑色,所以剩余固体中不含有________。将磁铁靠近黑色粉末,发现黑色粉末全部能被磁铁吸引,所以剩余固体中不含有_________。
【猜想与假设】猜想(1):剩余固体是Fe与Fe3O4;
猜想(2):剩余固体是Fe3O4。
【实验探究3】将黑色粉末移入试管,然后滴入稀盐酸,观察到黑色固体消失,且无气体产生。
【实验结论】猜想(2)成立。写出铁和水蒸气反应的化学方程式为______________。
【反思与交流】在实验探究3中,剩余固体消失是和固体和盐酸反应还是固体溶解到水中,请设计个一简单实验证明 ______________________ 。