题目内容
【题目】请根据下图所示的实验过程和提供的数据,计算样品中钠元素的质量_____。已知:![]() ,CaCl2 不与 NaCl 反应。
,CaCl2 不与 NaCl 反应。
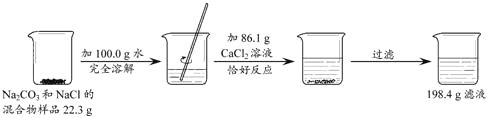
【答案】9.2g
【解析】
根据图中所给的数据结合质量守恒定律可以求出生成的碳酸钙的质量,然后可以根据沉淀的质量求出碳酸钠的质量,进而求出氯化钠的质量,再结合碳酸钠和氯化钠中钠元素的质量分数可以求出钠元素的质量。
根据质量守恒定律结合题给的数据可以知道生成碳酸钙的质量为:
22.3g+100.0g+86.1g-198.4g=10g,所以可以据此进行求算;
设混合物中碳酸钠的质量为x

![]()
x=10.6g
所以混合物中氯化钠的质量为22.3g-10.6g=11.7g;
所以在混合物中钠元素的质量为:

答:样品中钠元素的质量为9.2g。

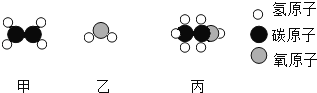
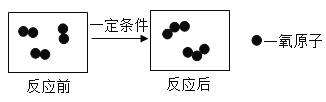
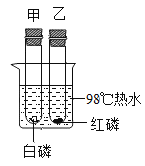
【题目】控制变量,设计对比实验是实验探究的重要方法。
实验 | 一、探究人体呼出气体中二氧化碳含量比空气中的高 | 二、探究影响品红扩散快慢的因素 | 三、铁钉锈蚀条件的探究 |
实验 |
|
|
|
实验 | 本实验条件除了要控制两个盛装气体样品的集气瓶大小规格相同外,还要控制 相同。 | 发现两杯水都变红,且整杯热水变红时间比冷水要短。由此说明:①分子在不断运动;②影响分子运动快慢的因素有 。 | 一周后,左边试管中铁钉生锈,右边试管中铁钉无明显变化。上述实验 |
【题目】下图是实验室制取气体的部分装置,请回答下列问题:
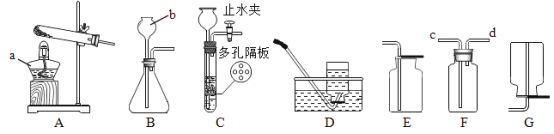
(1)写出仪器的名称:a 是_____,b 是_____。
(2)选择 A 装置制氧气的化学方程式_____,收集比较干燥的氧气,选择的收集装置是_____(填写编号)。
(3)实验室制 CO2 常选 C 作为发生装置,该装置的优点是_____。收集了一定量的气体后夹紧止水夹,C 装置中固体与液体无法分开,可能的原因是_____。若用 F 装置收集 CO2,气体应该从_____(填“c”或“d”)端通入,验满的方法为_____。
(4)某同学欲对当地的石灰石矿石样品进行检验,取用 50.0g 这种石灰石样品,把 200.0g 稀盐酸分 4 次加入, 实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。
序号 | 加入稀盐酸质量(g) | 剩余固体质量(g) |
第 1 次 | 50.0 | 40.0 |
第 2 次 | 50.0 | M |
第 3 次 | 50.0 | 20.0 |
第 4 次 | 50.0 | 12.0 |
请计算:
Ⅰ. 表中 m 的数值应该为_____。
Ⅱ. 石灰石样品中碳酸钙的质量是_____g。
Ⅲ. 参加反应的稀盐酸的溶质质量分数_____?(根据化学方程式列式计算)(精确到 0.1%)