题目内容
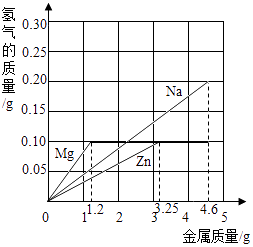
【题目】黄铜是铜和锌的合金,可以用来制造机器、电器零件及日常用品.为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的10%的稀硫酸,恰好完全反应,产生氢气0.2g.请解答以下问题:
(1)黄铜属于材料;
(2)该黄铜样品中铜的质量分数
(3)反应后所得溶液中溶质的质量分数是多少?(结果保留到0.1%)
【答案】
(1)金属
(2)67.5%
(3)解:稀H2SO4的质量: ![]() =98g
=98g
反应后所得溶液的质量分数是: ![]() ×100%=15.4%
×100%=15.4%
【解析】解:(1)黄铜是铜和锌的合金,属于金属材料.(2)设合金中锌的质量为x,稀H2SO4中溶质的质量为y,生成的硫酸锌的质量为z.
Zn+ | H2SO4═ | ZnSO4+ | H2↑ |
65 | 98 | 161 | 2 |
x | y | z | 0.2g |
![]()
解得:x=6.5g y=9.8g z=16.1g
铜的质量为20g﹣6.5g=13.5g;
铜的质量分数: ![]() ×100%=67.5%
×100%=67.5%
故答为:(1)金属;(2)67.5%;(3)反应后所得溶液的质量分数为15.4%.
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
相关题目
【题目】兴趣小组的同学发现,利用如图装置,可完成许多实验,请你回答下列问题: 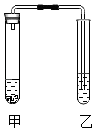
(1)【实验】
1 | 2 | 3 | |
甲(药品) | 浓氨水 | 碳酸钠、稀盐酸 | 水、氢氧化钠固体 |
乙(药品) | 无色酚酞溶液 | 澄清石灰水 | 水 |
现象 | 乙导管口有气泡冒出, | 乙导管口有气泡冒出 | |
结论和解释 | 分子具有的一条性质是 | 写出其中的一个化学方程式: | 出现该现象的原因是 |
(2)【交流与评价】 ①实验3中将氢氧化钠固体换成 , 原理一样,也会出现相同的现象.
②反应停止后将实验2中甲、乙两试管废液倒在一起,产生更多的沉淀,则反应停止后实验2甲试管溶液中的溶质是、 .