题目内容
【题目】往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算: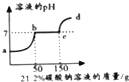
(1)a→b段表示碳酸钠与混合溶液中的反应;
(2)反应到c点时,所得溶液的溶质质量分数是多少?(写出计算过程,精确到0.1%)
【答案】
(1)稀盐酸
(2)
设盐酸和碳酸钠反应时,生成氯化钠质量为x,生成二氧化碳质量为y
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 117 44
21.2%×50g x y
![]() =
= ![]()
x=11.7g,
y=4.4g,
碳酸钠和氯化钙反应生成氯化钠质量为m,生成碳酸钙沉淀质量为n
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100 117
21.2%×100g n m
![]() =
= ![]()
m=23.4g,
n=20g,
所以所得溶液的溶质质量分数是 ![]() ×100%=15.6%.
×100%=15.6%.
【解析】(1)盐酸和氯化钙的混合溶液中,滴加稀盐酸,盐酸会先于碳酸钠,溶液的pH值升高,然后碳酸钠再与氯化钙反应,溶液的pH值不变,反应结束,溶液的pH值会继续的增大,所以a→b段表示碳酸钠与混合溶液中的稀盐酸反应;
所以答案是:(1)稀盐酸;(2)所得溶液的溶质质量分数是15.6%.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目