题目内容
【题目】Na2SO4可用于制造纸浆. 某Na2SO4样品中含有少量氯化钙,同学欲在实验室中提纯该Na2SO4样品,设计了如下流 程. 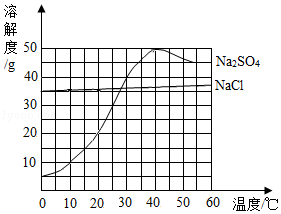

(1)操作②的名称是 .
(2)写出①的有关化学方程式 , 若所加Na2CO3过 量,可加入适量的(填名称)而除去.
(3)溶液N中的溶质一 定有 , 操作 ③是 , 此操作的温度控制在28℃以下,其原因是
【答案】
(1)过滤
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl;硫酸
(3)氯化钠和硫酸钠;降温结晶;28℃以下硫酸钠的溶解度小于氯化钠的溶解度,且变化明显
【解析】解:(1)操作②是将固体和液体进行分离的操作,称是过滤.(2)写出①是氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,对应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl.若所加Na2CO3过量,则导致硫酸钠中混有碳酸钠,需要除去,为避免引入新的杂质,所以加入硫酸除去碳酸钠.(3)溶液N中的溶质一定有过程生成的氯化钠和主要成分硫酸钠,在加热浓缩后,由于浓溶液同时含有氯化钠和硫酸钠,需要控制温度使硫酸钠析出而氯化钠不能析出,所以选择降温结晶,且温度控制在在28℃以下,其原因是 28℃以下硫酸钠的溶解度小于氯化钠的溶解度,且变化明显. 所以答案是:(1)过滤.(2)CaCl2+Na2CO3=CaCO3↓+2NaCl; 硫酸.(3)氯化钠和硫酸钠; 降温结晶; 28℃以下硫酸钠的溶解度小于氯化钠的溶解度,且变化明显.
【考点精析】解答此题的关键在于理解书写化学方程式、文字表达式、电离方程式的相关知识,掌握注意:a、配平 b、条件 c、箭号.

练习册系列答案
相关题目