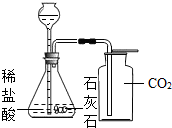
题目内容
为测定石灰石中碳酸钙的质量分数,化学兴趣小组的同学设计了以下方案:将94.4g稀盐酸加入到15g石灰石样品中,恰好完全反应。生成的二氧化碳气体全部用足量的NaOH溶液吸收,NaOH溶液增加的质量随时间变化如下表:(友情提示:石灰石中的杂质不参加反应且难溶于水)
| 时间(min) | t1 | t2 | t | t4 | t5 | t6 | t7 | t8 |
| 氢氧化钠溶液增加的质量(g) | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 4.4 | 4.4 |
求:(1)最终生成CO2的质量 ;
(2)样品中CaCO3的质量分数(计算结果精确到0.1%);
(3)将石灰石与稀盐酸反应后的剩余物质进行过滤,再![]() 向滤液中加入多少克水可以得到溶质质量分数为10%的CaCl2溶液。
向滤液中加入多少克水可以得到溶质质量分数为10%的CaCl2溶液。
(l)4.4g ![]()
![]() (1分)
(1分)
(2)解:设样品中CaCO3的质量为x.生成CaCl2的质量为y,加入水的质量为z。
![]() CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
x y 4.4g
![]() x = 10g
x = 10g
CaCO3的质量分数=![]()
![]()
![]() (1分)
(1分)
(3) ![]() y=11.1g
y=11.1g ![]()
![]() z =11g (1分)
z =11g (1分)
答;(2![]() ) CaCO3的质量分数为66.7% (3)所需加水的质量为11g。
) CaCO3的质量分数为66.7% (3)所需加水的质量为11g。

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| 时间(min) | t1 | t2 | t3 | t4 | t | t6 | t7 | t8 |
| 氢氧化钠溶液增加的质量(g) | 1.5 | 2 | 2.5 | 3 | 3.5 | 4 | 4.4 | 4.4 |
(2)样品中CaCO3的质量分数(计算结果精确到0.1%);
(3)将石灰石与稀盐酸反应后的剩余物质进行过滤,再向滤液中加入多少克水可以得到10%的CaCl2溶液.
| 稀盐酸的体积 | 第一次30mL | 第二次30mL | 第三次30mL | 第四次30mL | 第五次30mL |
| 剩余固体质量 | 40.0g | X | 20.0g | 10.0g | 5.0g |
(2)计算该石灰石样品中碳酸钙的质量分数是多少?
(3)若把该反应产生的二氧化碳全部收集起来,共有多少L?
(注意:①二氧化碳气体的密度为1.977g/L,②要求写出全部计算过程)