题目内容
【题目】自然界中无时不在进行着氧气、二氧化碳、水的循环,使地球充满勃勃生机.
(1)地球大气中二氧化碳含量增多,会产生_____,导致全球变暖。
(2)对维持大气中二氧化碳气体含量相对稳定,最重要的反应是______
ACO2+H2O=H2CO3 BCO2+NaOH=Na2CO3+H2O
CCO2+ C ![]() 2CO D6CO2 +6H2O
2CO D6CO2 +6H2O![]() 6C6H12O6+6O2
6C6H12O6+6O2
(3)饮用硬度过大的水都不利于人体健康.可通过_____方法来降低水的硬度。
(4)相同条件下气体体积之比等于分子数之比,则空气中氧分子与氮分子总质量之比为__________。
【答案】温室效应 D 煮沸 2:7
【解析】
(1)地球大气中二氧化碳含量增多,会产生温室效应,导致全球变暖;
(2)动植物呼吸,含碳燃料的燃烧产生大量二氧化碳,对维持大气中二氧化碳气体含量相对稳定,最重要的反应是消耗二氧化碳的反应,切实可行的应该是自然界中与碳的循环的光合作用,故选D;
(3)饮用硬度过大的水不利于人体健康.可通过煮沸的方法来降低水的硬度,因为煮沸能使水中的可溶性钙、镁化合物转化成沉淀,使水中可溶性钙、镁化合物减少;
(4)相同条件下气体体积之比等于分子数之比,由于空气中氮气和氧气的体积比为4:1,则空气中氧分子与氮分子总质量之比,32:4×28=2:7。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】如图1是以石灰石为原料制备高纯超细碳酸钙的工艺流程图:

(1)流程中操作A的名称_____。实验室里该操作用到的玻璃仪器有烧杯、_____和_____。
(2)主要反应原理:
①“煅烧”步骤:主要反应的化学方程式为_____,反应基本类型为_____反应。
②“浸出”步骤:CaO+2NH4Cl=CaCl2+H2O+2NH3↑。
③“碳化”步骤:CO2+2NH3+H2O+CaCl2=CaCO3↓+2 NH4Cl。
(3)煅烧石灰石得到的固体中,除含CaO外,还含有少量MgO、FeO等杂质,在“浸出”过程为保证铁、镁等杂质不被浸出,需要适当提高溶液的pH.根据反应②计算出的钙铵比(参加反应的氧化钙和氯化铵的质量比)为_____,而实际流程中最佳钙铵比要稍高于这一比值,原因是_____。
(4)用上述流程可循环使用的物质除了H2O、CO2和NH3之外,还有_____。
(5)实验室在如图2装置中模拟上述流程制备高纯超细碳酸钙:

①搅拌的作用是_____。
②制备CaCl2溶液时需要对装置加热,主要作用是_____。
A 加快反应速率 B 促进氨气逸出
③已知在常温和一个标准大气压下,CO2和NH3在100g水中分别能溶解0.169g和52.9g。制备CaCO3时应先通入氨气后通入二氧化碳,理由是_____。
④浸取一步中NH4Cl溶液的溶质质量分数直接影响着生成CaCl2溶液溶质质量分数。已知0﹣100℃时NH4Cl的溶解度如下表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解(g) | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
如果用200g 80℃时NH4Cl的饱和溶液与纯氧化钙恰好完全反应,计算充分反应后得到CaCl2的质量_____。(写出计算过程,保留一位小数。)
【题目】溶解度可表示物质溶解性的大小
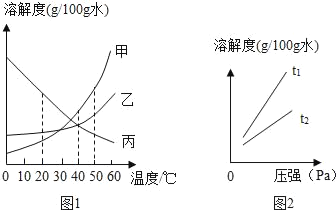
①如图1是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线
Ⅰ.20℃时,甲的溶解度_____(填“>”、“<”或“=”)乙的溶解度。
Ⅱ.40℃时,乙和丙_____(填“能”或“不能”)形成溶质质量分数相同的饱和溶液。
Ⅲ.20℃时,烧杯中分别盛有相同质量甲、乙、丙的饱和溶液,各加入等质量的对应固体,并升温至50℃.请填写下表。
烧杯中的溶质 | 烧杯中固体的变化 |
甲 | _____ |
乙 | 固体逐渐减少至全部溶解 |
丙 | _____ |
Ⅳ.若分别将100g乙、丙的饱和溶液从50℃降温到40℃,对所得溶液的叙述正确的_____(填序号)。
A 乙、丙都是饱和溶液 B 所含溶剂质量:乙<丙
C 溶液质量:乙>丙 D 溶质质量分数:乙>丙
②气体的溶解度也有一定的变化规律。
Ⅰ.打开可乐瓶,逸出大量气泡.由此可见,压强越小,CO2的溶解度越_____.为增大CO2的溶解度,可采用的一种方法是_____。
Ⅱ.不同温度下,氧气的溶解度随压强的变化如图2所示,图中t1对应的温度为40℃,则t2对应的温度_____(填编号)。
a 小于40℃ b 大于40℃ c 无法确定