题目内容
100g某稀硫酸恰好与13g锌完全起反应,试计算:
(1)稀硫酸中溶质的质量;
(2)该硫酸中溶质的质量分数.(保留到0.1%).(Zn+H2SO4=ZnSO4+H2↑)
(1)稀硫酸中溶质的质量;
(2)该硫酸中溶质的质量分数.(保留到0.1%).(Zn+H2SO4=ZnSO4+H2↑)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:据锌与硫酸反应的化学方程式,由13g锌的质量计算恰好完全反应时反应的硫酸的质量,然后利用溶液中溶质质量分数的计算公式,求出硫酸的质量分数.
解答:解:设反应的硫酸中溶质的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 98
13g x
=
x=19.6g
硫酸中溶质的质量分数:
×100%=19.6%.
答:(1)硫酸中溶质的质量为19.6g;
(2)硫酸中溶质的质量分数为19.6%.
Zn+H2SO4═ZnSO4+H2↑
65 98
13g x
| 65 |
| 98 |
| 13g |
| x |
x=19.6g
硫酸中溶质的质量分数:
| 19.6g |
| 100g |
答:(1)硫酸中溶质的质量为19.6g;
(2)硫酸中溶质的质量分数为19.6%.
点评:此题是对化学方程式计算的考查,解题的关键找准相关的质量关系.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
含碳物质构成了一个庞大的家族,下列含碳的物质属于纯净物的是( )
| A、石灰石 | B、石油 | C、煤 | D、干冰 |
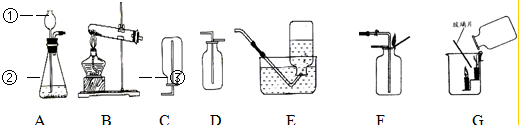
 如图所示的装置测定空气中氧气的含量.将燃烧匙中的红磷点燃迅速伸入集气瓶中并塞上橡胶塞.
如图所示的装置测定空气中氧气的含量.将燃烧匙中的红磷点燃迅速伸入集气瓶中并塞上橡胶塞.