题目内容
(2010?玄武区一模)某兴趣小组走进实验室看到了一个不和谐的“音符”(如图1).(I)此情此景你首先想到是取用该药品时试剂瓶瓶塞应______放在桌上;取用后应立即塞上瓶塞密封保存,这是因为______.
(II)该兴趣小组同学为了测定某变质的烧碱样品中Na2CO3的质量分数,首先设计了图2所示的装置,加入过量的盐酸反应后,通过右侧注射器内收集到气体的量计算出Na2CO3的质量分数(已知该状态下CO2的密度,所使用注射器最大量程为20mL).

写出锥形瓶内所发生变化的化学方程式______,______,
小张认为该方案测得Na2CO3的质量分数不够准确,这是因为______,且小李认为该方案中样品取用的量也需要一定的控制,这是因为______.
(III)该兴趣小组同学在反思上面实验后设计了如图3的装置测定变质的烧碱样品中Na2CO3的质量分数.反应的开始、结束都要用注射器反复的排送空气.实验步骤为:
①检查装置的气密性. ②称取10克干燥的烧碱样品放入广口瓶中,D处注射器内加入适量的稀硫酸,准确称量装置F的质量320克,连好装置. ③打开弹簧夹1,反复推拉注射器A 10次,准确称量装置F的质量320.5克.④关闭弹簧夹1,然后推动活塞,让稀硫酸逐滴滴入样品中,直到不再产生气泡为止. ⑤打开弹簧夹1,缓缓推拉注射器A 10次. ⑥再准确称装置F质量为321.6克.
问题探究:
(i)若步骤⑤中注射器A推拉速率过快,则测定的Na2CO3的质量分数会______(填“偏大”、“偏小”、“不变”).理由是______.
(ⅱ)试根据实验所记数据计算出该烧碱样品中Na2CO3的质量分数.(写出计算过程)
______.
【答案】分析:(I)如图,瓶塞要倒放,防止污染瓶塞;氢氧化钠固体易吸收空气中的水分而潮解,且与二氧化碳反应,所以必须马上盖瓶塞.
(II)已知“某变质的烧碱样品中有Na2CO3”,所以和盐酸反应的化学方程式应有两个.产生的二氧化碳中混杂水蒸气等会使测得Na2CO3的质量分数不够准确;而若样品取得过多过少,也不利于测量.
(III)(i)二氧化碳释放的太快,不能被氢氧化钠完全吸收;所以测定的Na2CO3的质量分数会偏小.
(ⅱ)打开弹簧夹1,准确称量装置F的质量320.5克和321.6克,其质量差为二氧化碳的质量.知道二氧化碳的质量,便可根据化学方程式计算出碳酸钠的质量,从而计算该烧碱样品中Na2CO3的质量分数.
解答:解:(I)如图,瓶塞要倒放,会污染药品.不盖瓶塞会使氢氧化钠固体变质.
(II)已知反应物和生成物,可以书写化学方程式;小李和小张的分析正确.
(III)(i)注意操作的力度,实验的准确性,会影响实验的结果.
(ⅱ)准确求出二氧化碳的质量,便可根据化学方程式计算出碳酸钠的质量,从而计算该烧碱样品中Na2CO3的质量分数.
故答为:(I)倒;防止氢氧化钠固体吸水潮解和与二氧化碳反应变质;
(II)NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑;产生的二氧化碳中混杂水蒸气、加入的盐酸的体积没有除去等(任写一种,合理答案均给分);若样品取多了,产生气体可能超过注射器量程,若样品取少了,产生气体太少,无法测量.
(III)(i)偏小;生成二氧化碳气体不能完全被NaOH溶液吸收(合理答案均给分)
(ⅱ)二氧化碳的质量=321.6g-320.5g=1.1g(0.5分)
解:设样品中碳酸钠的质量为x,
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O(1分)
106 44
X 1.1g
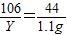 x=2.65g(1分)
x=2.65g(1分)
样品中碳酸钠的质量分数为: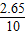 ╳100%=26.5%(0.5分)
╳100%=26.5%(0.5分)
答:该烧碱样品中Na2CO3的质量分数为26.5%.
点评:本题主要探究药品是否变质,掌握探究物质的组成成分以及含量的方法,学会实验数据处理或误差的分析;重点是:掌握根据化学方程式计算的步骤和方法.
(II)已知“某变质的烧碱样品中有Na2CO3”,所以和盐酸反应的化学方程式应有两个.产生的二氧化碳中混杂水蒸气等会使测得Na2CO3的质量分数不够准确;而若样品取得过多过少,也不利于测量.
(III)(i)二氧化碳释放的太快,不能被氢氧化钠完全吸收;所以测定的Na2CO3的质量分数会偏小.
(ⅱ)打开弹簧夹1,准确称量装置F的质量320.5克和321.6克,其质量差为二氧化碳的质量.知道二氧化碳的质量,便可根据化学方程式计算出碳酸钠的质量,从而计算该烧碱样品中Na2CO3的质量分数.
解答:解:(I)如图,瓶塞要倒放,会污染药品.不盖瓶塞会使氢氧化钠固体变质.
(II)已知反应物和生成物,可以书写化学方程式;小李和小张的分析正确.
(III)(i)注意操作的力度,实验的准确性,会影响实验的结果.
(ⅱ)准确求出二氧化碳的质量,便可根据化学方程式计算出碳酸钠的质量,从而计算该烧碱样品中Na2CO3的质量分数.
故答为:(I)倒;防止氢氧化钠固体吸水潮解和与二氧化碳反应变质;
(II)NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑;产生的二氧化碳中混杂水蒸气、加入的盐酸的体积没有除去等(任写一种,合理答案均给分);若样品取多了,产生气体可能超过注射器量程,若样品取少了,产生气体太少,无法测量.
(III)(i)偏小;生成二氧化碳气体不能完全被NaOH溶液吸收(合理答案均给分)
(ⅱ)二氧化碳的质量=321.6g-320.5g=1.1g(0.5分)
解:设样品中碳酸钠的质量为x,
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O(1分)
106 44
X 1.1g
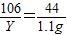 x=2.65g(1分)
x=2.65g(1分)样品中碳酸钠的质量分数为:
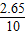 ╳100%=26.5%(0.5分)
╳100%=26.5%(0.5分)答:该烧碱样品中Na2CO3的质量分数为26.5%.
点评:本题主要探究药品是否变质,掌握探究物质的组成成分以及含量的方法,学会实验数据处理或误差的分析;重点是:掌握根据化学方程式计算的步骤和方法.

练习册系列答案
相关题目
(2010?玄武区一模)实验室制取气体的装置如下图所示,根据所学的知识回答下列问题.

(1)图中标有①、②的仪器名称:①;②.
(2)写出用装置A制氧气的一个化学方程式.
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,应选择的发生装置为(填写装置的字母代号,下同);应选用的收集装置是.检验二氧化碳是否收集满的方法是:.
(4)查阅以下资料
则制取氯气(填可以或不可以)采用装置A,理由是.

(1)图中标有①、②的仪器名称:①;②.
(2)写出用装置A制氧气的一个化学方程式.
(3)实验室用石灰石和稀盐酸反应制取二氧化碳,应选择的发生装置为(填写装置的字母代号,下同);应选用的收集装置是.检验二氧化碳是否收集满的方法是:.
(4)查阅以下资料
| 物质 | 制取气体的药品 | 制取气体的反应条件 | 气体的物理性质 |
| 氯气 | MnO2固体和浓盐酸 | 需要加热 | 可溶于水,密度比空气大 |
