题目内容
下列因素中,与固体物质的溶解度无关的是
- A.溶质的种类
- B.溶剂的种类
- C.温度的高低
- D.溶质、溶剂量的多少
D
分析:根据固体的溶解度概念分析.
解答:固体的溶解度指一定温度下,100g溶剂水中达到饱和状态所溶解的溶质的质量,所以固体的溶解度和温度、溶质种类和溶剂种类有关;和溶质、溶剂量的多少无关.
故选D.
点评:影响固体的溶解度的因素有溶质种类、溶剂种类和温度.多数固体的溶解度随温度的升高而增大,少数的固体的溶解度受温度的影响极小,极少数的固体的溶解度随温度的升高而减小.
分析:根据固体的溶解度概念分析.
解答:固体的溶解度指一定温度下,100g溶剂水中达到饱和状态所溶解的溶质的质量,所以固体的溶解度和温度、溶质种类和溶剂种类有关;和溶质、溶剂量的多少无关.
故选D.
点评:影响固体的溶解度的因素有溶质种类、溶剂种类和温度.多数固体的溶解度随温度的升高而增大,少数的固体的溶解度受温度的影响极小,极少数的固体的溶解度随温度的升高而减小.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
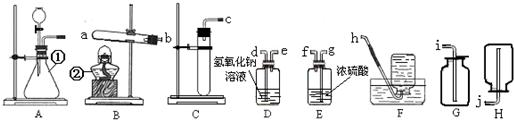
 (2012?卢湾区一模)图-1是实验室制取二氧化碳气体的装置图,请回答下列问题:
(2012?卢湾区一模)图-1是实验室制取二氧化碳气体的装置图,请回答下列问题: