题目内容
托盘天平两边烧杯中盛有从同一瓶中倒出的质量相同的足量稀硫酸,调节天平指针至平衡.向左边烧杯中加入5.6g铁粉,向右边烧杯加入Mg与MgO的混合粉末5.6g,充分反应后,天平仍保持平衡状态,则右边混合粉末中Mg与MgO的质量比为________.
3:4
分析:因天平仍然平衡,说明反应后生成的氢气一样多,据此可以计算出混合物中镁的质量和氧化镁的质量,最后得出本题答案.
解答:设混合物中镁的质量为x.
由Fe+H2SO4=FeSO4+H2↑和Mg+H2SO4=MgSO4+H2↑
得Fe→Mg
56 24
5.6g x
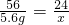
x=2.4g
氧化镁的质量为5.6g-2.4g=3.2g
镁与氧化镁的质量比为:2.4g:3.2g═3:4
故答案为:3:4
点评:本题主要考查有关化学方程式的计算和化学式的计算,难度较大.
分析:因天平仍然平衡,说明反应后生成的氢气一样多,据此可以计算出混合物中镁的质量和氧化镁的质量,最后得出本题答案.
解答:设混合物中镁的质量为x.
由Fe+H2SO4=FeSO4+H2↑和Mg+H2SO4=MgSO4+H2↑
得Fe→Mg
56 24
5.6g x
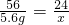
x=2.4g
氧化镁的质量为5.6g-2.4g=3.2g
镁与氧化镁的质量比为:2.4g:3.2g═3:4
故答案为:3:4
点评:本题主要考查有关化学方程式的计算和化学式的计算,难度较大.

练习册系列答案
相关题目