题目内容
【题目】某兴趣小组同学对实验室制取氧气的若干问题进行如下探究。
【问题一】:实验室制取氧气的原料的选择
在KClO3、H2O、H2O2、NaCl这些物质中寻找制取氧气的原料,肯定不能作为分解反应原料的物质是_______,说出你的判断依据________________________。
【问题二】:设计实验发生装置和收集装置
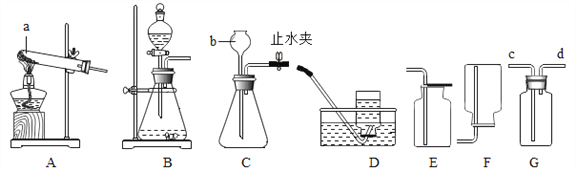
以下是实验室制取气体可能用到的装置:
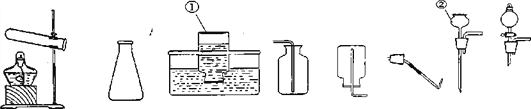
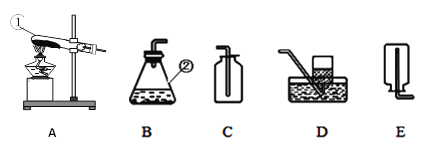
A B C D E F G H
(1) 写出编号仪器的名称①__________;
(2) 实验室用氯酸钾和二氧化锰的混合物制取并收集较纯净的氧气,可选择的装置组合为_______(填字母);反应前后,二氧化猛的作用是__________。
(3)为了得到稳定的气流,实验室用过氧化氢溶液制氧气时应选择______(填字母)组合成
发生装置。反应的化学方程式是___________________________________
该反向的基本反应类型是_____________
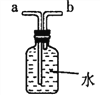
(4)若用上述原理制取氧气并用C装置来收集时,若集气瓶口有气泡冒出,说明集气瓶内的氧气已收集满,接下来的操作是(请选择正确的操作及顺序,填编号)_____________,正放在桌面上。
a.盖上玻璃片 b.将导管移出 c.将集气瓶移出水面
(5)实验室取15克氯酸钾和5克二氧化锰混合制备氧气,加热一段时间后,剩余固体质量为15.2克,则①产生氧气的质量为___________克。
②参加反应的的氯酸钾的物质的量是________?(根据化学方程式计算)
【答案】 NaCl 根据质量守恒定律,化学反应前后元素的种类不变,NaCl中不含氧元素,所以不能用来制取氧气 集气瓶 AFC 催化作用,加快反应速率 BH 2H2O2![]() 2H2O+O2↑ 分解反应 bac 4.8 0.1mol
2H2O+O2↑ 分解反应 bac 4.8 0.1mol
【解析】【问题一】:实验室制取氧气的原料的选择在KClO3、H2O、H2O2、NaCl这些物质中寻找制取氧气的原料,肯定不能作为分解反应原料的物质是NaCl,因为根据质量守恒定律,化学反应前后元素的种类不变,NaCl不含氧元素,所以不能用来制取氧气;
【问题二】:(1)集气瓶是常用的反应容器;
(2)如果用氯酸钾和二氧化锰制氧气就需要加热,其中二氧化锰起催化作用;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集,排水法收集的氧气比较纯净,故为:AFC;
(3)如果用双氧水和二氧化锰制氧气就不需要加热,分液漏斗可以控制反应的速率;过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平,化学方程式为2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(4)若用上述原理制取氧气并用C装置来收集时,若集气瓶口有气泡冒出,说明集气瓶内的氧气已收集满,接下来的操作是:将导管移出、将集气瓶移出水面、盖上玻璃片;故为:bac;
(5)根据质量守恒定律,氧气的质量=15g+5g-15.2g=4.8g,生成的氧气的物质的量=![]() =0.15mol;
=0.15mol;
设参加反应的氯酸钾的物质的量是x
2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
2mol 3mol
x0.15mol
![]()
x=0.1mol;
答:参加反应的氯酸钾的物质的量是0.1mol。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案