��Ŀ����
����Ŀ����ѧ�����빫����ճ�����������أ�Ҳ���ƽ���������Ϳ�ѧ������������Ҫ������
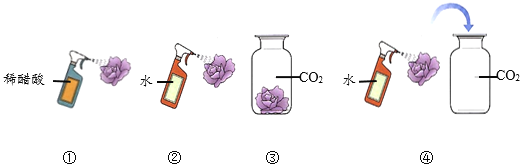
��1�������������ٶ������Զ�ʱ���ȣ��Զ�ֹͣ���Զ�������������С����������ˮ����עˮ�Ĵ��������۽Ƕȿ���ˮ����ˮ���ٵ�ԭ����_____���ݴ��Ʋ����Ӱ�����˶��Ŀ�����������_____��
��2���ҹ���ѧ���о�������ij�ֳ���������Ϊʳ���ܽ�����ϩ���۱���ϩ�Ƚ����ΪCO2������ϩ���۱���ϩ����_____���ϣ����潵����������_____�仯��������Ч����Ļ���������_____��
��3��������һ�ּ��߷�չDZ���������Դ���ֽ�ˮ�����һ��ԭ����ͼ��ʾ��
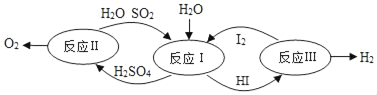
����ӦI�У���Ӧǰ�ϼ۷����ı��Ԫ����_____��
����Ӧ��ķ�Ӧ����Ϊ_____��
�������ϣ�ÿ����32gO2�ܵõ�_____gH2��
���𰸡������Dz����˶��� �¶� �л��ϳɣ� ��ѧ ��ɫ��Ⱦ �� �ֽⷴӦ 4
��������
�����Dz����˶��ģ�����������ⷢ��������ԭ��Ӧ��������͵⻯�⡣
��1�����۽Ƕȿ���ˮ����ˮ���ٵ�ԭ���Ƿ����Dz����˶��ģ��Ʋ����Ӱ�����˶��Ŀ������������¶ȡ�
��2������ϩ���۱���ϩ�����л��ϳɲ��ϣ����潵�����ϵĹ����������������ɣ����ڻ�ѧ�仯��������Ч����Ļ��������ǰ�ɫ��Ⱦ��
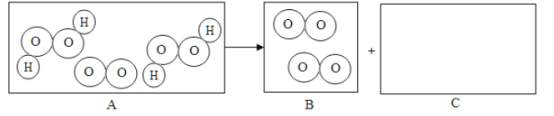
��3���� ��ͼ��֪����ӦIΪ����������ⷢ��������ԭ��Ӧ���������HI����ѧ����ʽΪ��SO2+2H2O+I2��H2SO4+2HI��������Ԫ����+4�۱��+6�ۡ���Ԫ�صĻ��ϼ���0�۱�ɩ�1�ۡ�
����ͼʾ��֪����Ӧ��Ļ�ѧ����ʽΪ2HI��H2+I2��������Ӧ���ϡ�һ��ࡱ�����������������Ϊ�ֽⷴӦ��
������������������Ϊx����Ӧ��ķ���ʽΪ��SO2+2H2O+I2��H2SO4+2HI����Ӧ��ķ���ʽΪ��2H2SO4��2SO2��+2H2O+O2������Ӧ��Ļ�ѧ����ʽΪ2HI��H2+I2��������������ѧ����ʽ�ɵ����¹�ϵ��

![]()
![]()
ÿ����32gO2�ܵõ�4gH2��

����Ŀ������ѡ�õij����Լ���ʵ���������ȷ����(������Ϊ����)
ѡ�� | ���� | ����ѡ�õ��Լ��Ͳ��� |
A | NaCl����(Na2CO3)���� | �����������ᣬ��������ַ�Ӧ�������ᾧ |
B | KCl����(KClO3)���� | ����������MnO2������ |
C | CO2(CO) | ͨ��������������ȼ |
D | NaNO3��Һ(NaOH��Һ) | ��������CuSO4��Һ������ |
A. AB. BC. CD. D
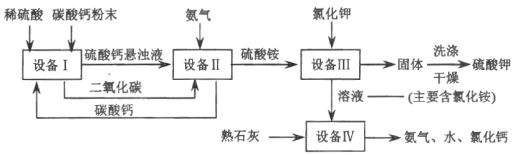
����Ŀ��ij�������÷������Ʊ�����ص��������£���ش���������:
����:��֪20��ʱ����李�������ܽ�����±�:
���� | ����� | �Ȼ��� | �Ȼ�� | ����� |
�ܽ��/g(20��) | 11.1 | 34.2 | 37.2 | 75.4 |
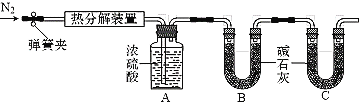
(1)���豸I���н�̼����гɷ�ĩ��Ŀ����___________��
(2)���豸II���з����Ļ�ѧ��Ӧ����ʽ��____________������______�����ͨ����������ͨ������̼����
(3)���豸III���з����Ļ�ѧ��Ӧ����ʽ��___________��
ϴ�Ӵӡ��豸III���еõ��Ĺ���ʱ������ˮ�����ñ����������Һ����Ŀ����________��
(4)���������п�ѭ��ʹ�õ����ʳ�ˮ�⣬����___________(��д��ѧʽ).