题目内容
(2012?朝阳区二模)下图是实验室用于制取气体、验证性质的装置图,请回答下列问题:
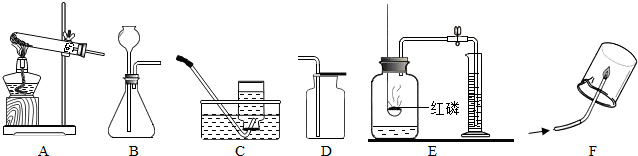
(1)实验室用高锰酸钾制取氧气的化学方程式为
(2)实验室制备二氧化碳的化学反应方程式为
(3)用排空气法收集一瓶氧气,验满时将带火星的木条放在瓶口,若观察到
(4)E装置利用可燃物消耗瓶内的
(5)F实验可检验甲烷的成分,将内壁一半涂澄清石灰水、一半干燥的小烧杯罩在火焰上方,观察到的实验现象是

(1)实验室用高锰酸钾制取氧气的化学方程式为
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
,所选用的发生装置是
| ||
A
A
(填字母,下同).(2)实验室制备二氧化碳的化学反应方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
,所选用的收集装置是D
D
.(3)用排空气法收集一瓶氧气,验满时将带火星的木条放在瓶口,若观察到
木条复燃
木条复燃
,说明瓶中已充满氧气.(4)E装置利用可燃物消耗瓶内的
氧气
氧气
,使瓶内压强减小来测定空气中氧气的含量.(5)F实验可检验甲烷的成分,将内壁一半涂澄清石灰水、一半干燥的小烧杯罩在火焰上方,观察到的实验现象是
澄清石灰水变浑浊,干燥烧杯内壁有无色液滴
澄清石灰水变浑浊,干燥烧杯内壁有无色液滴
.分析:(1)实验室用高锰酸钾加热分解生成锰酸钾和二氧化锰和氧气,该反应的发生装置根据反应物的状态和反应条件选择;
(2)实验室制备二氧化碳用石灰石和稀盐酸产生氯化钙、水和二氧化碳,根据二氧化碳易溶于水、密度比空气大选择收集装置;
(3)验满氧气时应将带火星的木条放在瓶口,看木条是否复燃;
(4)根据用红磷测定空气中的氧气原理分析;
(5)根据质量守恒定律中化学反应前后元素的种类不变分析.
(2)实验室制备二氧化碳用石灰石和稀盐酸产生氯化钙、水和二氧化碳,根据二氧化碳易溶于水、密度比空气大选择收集装置;
(3)验满氧气时应将带火星的木条放在瓶口,看木条是否复燃;
(4)根据用红磷测定空气中的氧气原理分析;
(5)根据质量守恒定律中化学反应前后元素的种类不变分析.
解答:解:(1)实验室用高锰酸钾加热分解生成锰酸钾和二氧化锰和氧气,反应的方程式为:2KMnO4
K2MnO4+MnO2+O2↑;该反应的发生装置属于固固加热型,故选择A;
(2)实验室制备二氧化碳用石灰石和稀盐酸产生氯化钙、水和二氧化碳,反应的方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为二氧化碳易溶于水、密度比空气大,故采用向上排空气法收集;
(3)验满氧气时应将带火星的木条放在瓶口,若木条复燃,说明已收集满;
(4)用红磷测定空气中的氧气是利用红磷消耗密闭容器内的氧气使装置内的气压减小,而不产生新的气体来测定的,故答案为:氧气;
(5)根据化学反应前后元素的种类不变可知:甲烷燃烧时其中的碳元素转化成二氧化碳,氢元素转化成水,所以会看到的现象是澄清石灰水变浑浊,干燥烧杯内壁有无色液滴,即说明有二氧化碳和水的生成,从而也说明了甲烷是由碳元素和氢元素组成的.
故答案为:(1)2KMnO4
K2MnO4+MnO2+O2↑ A
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑ D
(3)木条复燃 (4)氧气
(5)澄清石灰水变浑浊,干燥烧杯内壁有无色液滴
| ||
(2)实验室制备二氧化碳用石灰石和稀盐酸产生氯化钙、水和二氧化碳,反应的方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;因为二氧化碳易溶于水、密度比空气大,故采用向上排空气法收集;
(3)验满氧气时应将带火星的木条放在瓶口,若木条复燃,说明已收集满;
(4)用红磷测定空气中的氧气是利用红磷消耗密闭容器内的氧气使装置内的气压减小,而不产生新的气体来测定的,故答案为:氧气;
(5)根据化学反应前后元素的种类不变可知:甲烷燃烧时其中的碳元素转化成二氧化碳,氢元素转化成水,所以会看到的现象是澄清石灰水变浑浊,干燥烧杯内壁有无色液滴,即说明有二氧化碳和水的生成,从而也说明了甲烷是由碳元素和氢元素组成的.
故答案为:(1)2KMnO4
| ||
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑ D
(3)木条复燃 (4)氧气
(5)澄清石灰水变浑浊,干燥烧杯内壁有无色液滴
点评:本题主要考查了气体制取的反应原理及利用元素守恒法证明物质的组成,既是重点,又是考查热点,此种题目考查形式多样,要求学生能在理解的基础上熟练运用.

练习册系列答案
相关题目

