题目内容
【题目】氢氧化钠和氢氧化钙是两种常见的碱。李红同学将两种碱的溶液分别装人试管A 、B 中,并进行了如下图所示的三组实验。
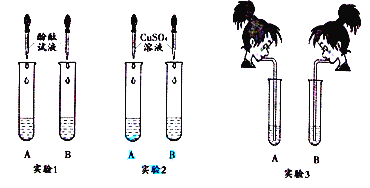
(1)实验l 中,两支试管的溶液都变成 色。
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为 ,
该反应的墓本类型是 反应。
(3)实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为 。B 中无现象,为了探究吹气后B 中溶质的成分,李红进行了如下探究。
提出猜想:
猜想1 :溶质只有氢氧化钠
猜想2 :溶质只有碳酸钠
猜想3 :溶质有氢氧化钠和碳酸钠
……
实验和结论:
实验 | 实验现象 | 结论 |
取B 中少量溶液,加人澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液。 | 产生白色沉淀 溶液呈现红色 | 猜想3成立 |
反思与评价:
老师评价李红得出的结论不正确,是因为猜想 (填数字)也会产生相同的现象。如果要验证“猜想3成立”,必须要换试剂,将 溶液换成 溶液。
【答案】(1)红 (2)2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓ 复分解
(3)Ca(OH)2 + CO2 = CaCO3↓+ H2O
反思与评价:2 氢氧化钙 氯化钙
【解析】
试题分析:(1)碱能使无色酚酞溶液变红,故实验l 中,两支试管的溶液都变成红
(2)实验2中,若B 盛装的是NaOH 溶液,发生反应的化学方程式为2NaOH + CuSO4 = Na2SO4 + Cu(OH)2↓;该反应由两种化合物相互交换成分生成另两种化合物,属于复分解反应
(3)呼出的气体中含有二氧化碳,二氧化碳能使澄清石灰水变浑浊,故实验3中,李红同学向两支试管吹气,A 中有白色沉淀生成,发生反应的化学方程式为:Ca(OH)2 + CO2 = CaCO3↓+ H2O
反思与评价:因为取B 中少量溶液,加人澄清石灰水,可能发生反应:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH ,即反应生成了氢氧化钠,故过滤后取上层清液,向其中加几滴酚酞试液,即使原溶液中没有氢氧化钠,酚酞试液同样变红,故李红得出的结论不正确,是因为猜想2也会产生相同的现象如果要验证“猜想3成立”,在验证并除去碳酸钠的时候,就不能引入新的碱;故必须要换试剂,将氢氧化钙溶液换成氯化钙溶液,这样发生反应:CaCl2+Na2CO3=CaCO3↓+2NaCl,生成NaCl,对氢氧化钠的判断没有影响




