题目内容
某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计了如下实验方案:利用如图实验装置,在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
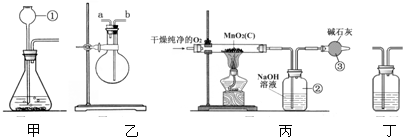
(1)仪器①的下端插在液面下是为了防止________,如果该实验选择甲装置来制取氧气,则反应的化学方程式为________.
(2)丙是用干燥纯净的O2与样品反应来测定二氧化锰质量分数的装置,仪器③中装有碱石灰,其作用是________.
(3)为验证装置丙中②已将CO2吸收完全,可在②与③之间加入丁装置进行证明,则丁装置中加入的试剂为________
A.浓盐酸 B.澄清石灰水 C.烧碱溶液 D.浓硫酸
(4)称取8g二氧化锰样品进行实验,丙中装置②反应前后的质量差为1.1g,计算样品中二氧化锰的质量分数为多少?
解:(1)为防止生成的气体从长颈漏斗逸出,长颈漏斗下端应伸入液面以下;本装置适用于固体物质与液体反应不需加热制取气体,因此选择该装置制取氧气时,应选择过氧化氢分解的反应;
故答案为:
产生的气体从长颈漏斗逸散到空气中,2H2O2 2H2O+O2↑;
2H2O+O2↑;
(2)丙装置中仪器②用来吸收反应所产生的二氧化碳气体,如果该装置直接与外界大气相连,则会因吸收空气中的二氧化碳而使测定结果出现较大偏差,因此连接仪器③用来吸收空气中的二氧化碳,防止空气中二氧化碳与仪器②中溶液发生反应;
故答案为:吸收空气中的二氧化碳,使实验数据更准确;
(3)检验二氧化碳气体,应使用澄清石灰水,因此在丁装置内应放入澄清石灰水;
故选B;
(4)解:设样品中二氧化锰的质量分数为x%.
C+O2 CO2
CO2
12 44
8 g×(1-x%) 1.1 g
 =
=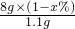
解得x%=96.25%
答:样品中二氧化锰的质量分数为96.25%.
分析:(1)根据装置的用途分析长颈漏斗伸入液面以下的原因,并判断使用该装置制取氧气时的反应方程式;
(2)根据实验目的,分析碱石灰的作用;
(3)验证二氧化碳用澄清的石灰水;
(4)利用化学方程式,由生成气体的质量计算参加反应的碳的质量,进而求出药品中二氧化锰的质量分数.
点评:本题考查知识综合而全面,解题时分析探究过程中各装置的作用,理清探究思路,并根据探究思路逐步进行分析,才能找出解决问题的方法.
故答案为:
产生的气体从长颈漏斗逸散到空气中,2H2O2
 2H2O+O2↑;
2H2O+O2↑;(2)丙装置中仪器②用来吸收反应所产生的二氧化碳气体,如果该装置直接与外界大气相连,则会因吸收空气中的二氧化碳而使测定结果出现较大偏差,因此连接仪器③用来吸收空气中的二氧化碳,防止空气中二氧化碳与仪器②中溶液发生反应;
故答案为:吸收空气中的二氧化碳,使实验数据更准确;
(3)检验二氧化碳气体,应使用澄清石灰水,因此在丁装置内应放入澄清石灰水;
故选B;
(4)解:设样品中二氧化锰的质量分数为x%.
C+O2
 CO2
CO2 12 44
8 g×(1-x%) 1.1 g
 =
=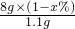
解得x%=96.25%
答:样品中二氧化锰的质量分数为96.25%.
分析:(1)根据装置的用途分析长颈漏斗伸入液面以下的原因,并判断使用该装置制取氧气时的反应方程式;
(2)根据实验目的,分析碱石灰的作用;
(3)验证二氧化碳用澄清的石灰水;
(4)利用化学方程式,由生成气体的质量计算参加反应的碳的质量,进而求出药品中二氧化锰的质量分数.
点评:本题考查知识综合而全面,解题时分析探究过程中各装置的作用,理清探究思路,并根据探究思路逐步进行分析,才能找出解决问题的方法.

练习册系列答案
相关题目