题目内容
 硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答:
硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答:
(1)由于加入硫酸铜溶液而使反应变快的是______ (填a或b).
(2)充分反应后得到的H2质量较大的是______ (填a或b),这是因为______.
解:(1)a和b图象中反应完全时a用的时间较短,也就是速度较快.
(2)反应完全后b的图象在a的上方,生成的氢气量多,这是因为a是在加入硫酸铜时锌与硫酸铜反应了一部分,导致生成的氢气量变小了,
故答案为:a;b;b中没有硫酸铜加入,锌粒全部与稀硫酸发生了反应(或答a中因加入了硫酸铜,锌粒没有全部与稀硫酸发生反应).
分析:(1)变快即是反应时所用的时间较短.
(2)最终反应后图象在上方的即是生成氢气较多的图象.
点评:此题是一道图象分析题,解题的关键是对图象的意义的认识,结合金属与盐溶液的反应特点即可轻松解题.
(2)反应完全后b的图象在a的上方,生成的氢气量多,这是因为a是在加入硫酸铜时锌与硫酸铜反应了一部分,导致生成的氢气量变小了,
故答案为:a;b;b中没有硫酸铜加入,锌粒全部与稀硫酸发生了反应(或答a中因加入了硫酸铜,锌粒没有全部与稀硫酸发生反应).
分析:(1)变快即是反应时所用的时间较短.
(2)最终反应后图象在上方的即是生成氢气较多的图象.
点评:此题是一道图象分析题,解题的关键是对图象的意义的认识,结合金属与盐溶液的反应特点即可轻松解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 25、硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答:
25、硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答: (1)法国佳士得拍卖行2009年3月26日拍卖圆明园流失文物鼠首和兔首铜像,拍卖圆明园兽首伤害了中国人民的感情,遭到全中国人民的强烈反对.用化学知识解释鼠首和兔首铜像经历150多年,保存相当完好而没有严重锈蚀的原因是:
(1)法国佳士得拍卖行2009年3月26日拍卖圆明园流失文物鼠首和兔首铜像,拍卖圆明园兽首伤害了中国人民的感情,遭到全中国人民的强烈反对.用化学知识解释鼠首和兔首铜像经历150多年,保存相当完好而没有严重锈蚀的原因是: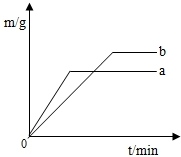
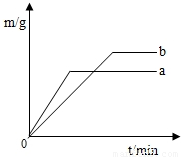 (2002?宁德)硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答:
(2002?宁德)硫酸铜溶液可以使锌与稀硫酸的反应变快.在a、b两份稀硫酸(足量)中各加入等质量的锌粒,其中一份还滴入少量的硫酸铜溶液,反应过程生成的H2质量(m)与时间(t)的关系如右图,试回答: