题目内容
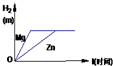
如图是等质量的Mg、Al、Zn与足量的稀硫酸反应,生成氢气质量随时间的变化图示.请根图示判断,三种金属X、Y、Z分别是( )

| A.Mg、Zn、Al | B.Mg、Al、Zn | C.Al、Mg、Zn | D.Zn、Mg、Al |

Mg、Al、Zn三种金属化合价均是+2,且质量相等,其相对原子质量分别是24、27、65,分别与足量稀硫酸反应,则依据氢气的质量=
| 金属的化合价 |
| 金属的相对原子质量 |
三种金属的活动性顺序是Mg>Al>Zn,所以与相同浓度的稀硫酸反应时反应最快的金属是镁,表现在图象中应该是斜率最大的物质;最慢的为锌.
故选:C.

练习册系列答案
相关题目