题目内容
【题目】下列图像分别与选项中的操作相对应,其中合理的是
A.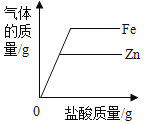 分别向相等质量的锌、铁中加入等质量分数的盐酸
分别向相等质量的锌、铁中加入等质量分数的盐酸
B.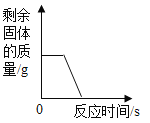 高温煅烧一定质量的石灰石
高温煅烧一定质量的石灰石
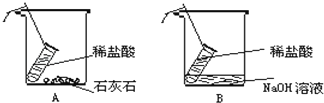
C.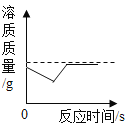 向室温下的饱和石灰水中加入生石灰
向室温下的饱和石灰水中加入生石灰
D.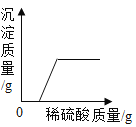 向硝酸钡和氢氧化钾的混合溶液中滴加稀硫酸
向硝酸钡和氢氧化钾的混合溶液中滴加稀硫酸
【答案】A
【解析】
A、每56份质量的铁会生成2份质量的氢气,每65份质量的锌会生成2份质量的氢气。所以分别向相等质量的锌、 铁中加入等质量分数的盐酸,铁生成的氢气多。A正确;
B、石灰石的主要成分是碳酸钙,碳酸钙高温分解生成氧化钙和二氧化碳。完全反应后固体的质量不可能为0,故图象不能正确反映其对应操作中各量的变化关系。B错误;
C、氧化钙溶于水会放热导致溶液温度升高,氢氧化钙溶解度下降,溶液中的溶质变少。过一会儿后溶液温度恢复到室温,其溶解度会恢复到原来的量。但由于氧化钙溶于水时消耗了水,所以溶液中的能溶解的溶质一定比原来要少,加入生石灰量较多,溶质可能为零。图象不能反映该过程。C错误;
D、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀,一开始就会出现沉淀。而图象显示是过一段时间才出现沉淀。D错误。
故选A。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】某校化学兴趣小组对“大理石与稀盐酸反应快慢与温度的关系”进行了探究。
[实验探究]在不同温度下测量收集等体积CO2所需的时间及溶液温度变化(盐酸浓度18%、大理石颗粒大小均匀、质量相同),如下表:
温度/°C | 需要的时间/s | 温度变化/°C |
15 | 145 | +1 |
20 | 105 | +1 |
25 | 73 | +3 |
30 | 51 | +3 |
35 | 30 | +4 |
(1)写出大理石和稀盐酸反应的化学方程式_____________________。
(2)根据上表分析,大理石和稀盐酸反应过程中伴随着________________________(填“吸热”或“放热”现象)。
(3)在实验中控制的变量有_____________________________(填写一种即可)。
[实验结论]
(4)实验结果_______________________(填“可靠”或“不可靠”),理由是______________________。
[评价与反思]
(5)根据上表数据分析,你认为实验中温度计的灵敏度__________(填“高”或“不高”),其原因是______。
(6)除了温度,大理石和稀盐酸反应的快慢还可能受哪些因素的影响?请设计方案验证:
[影响因素]______________________。
[实验方案]______________________。