题目内容
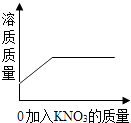
【题目】在一次探究实验中,某学习小组将质量为a g的高锰酸钾充分加热至不再放出气体为止,若试管中剩余固体的质量随时间变化关系如下图所示。请计算:
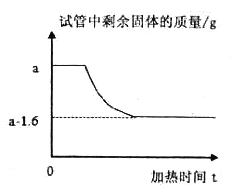
(1)反应中共生成氧气的质量。
(2)反应后剩余固体中钾、锰两种元素的质量比。
(3)该小组加入的高锰酸钾的质量是多少?(要求写出解答过程)
【答案】(1)1.6;(2)39∶55;(3)15.8
【解析】(1)生成氧气的质量为:ag(a1.6)g=1.6g;(2)剩余固体中钾和锰元素的质量等于原高锰酸钾中钾元素和锰元素的质量,故钾元素和锰元素的质量比为:39:55;(3)设开始加入的高锰酸钾的质量为x,
2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
x 1.6g
31632=x1.6g
x=15.8g
答:(1)反应中共生成氧气的质量为1.6g,(2)反应后剩余固体中钾、锰两种元素的质量比为:39:55;(3)开始加入的高锰酸钾的质量为15.8g。

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目