题目内容
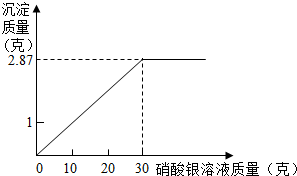
 为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10克该氯化钠溶液,然后向其中加入AgNO3溶液,发生复分解反应生成AgCl沉淀.滴加硝酸银溶液质量与产生沉淀质量关系如图所示.根据实验计算,该氯化钠溶液中溶质的质量分数是多少?
为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10克该氯化钠溶液,然后向其中加入AgNO3溶液,发生复分解反应生成AgCl沉淀.滴加硝酸银溶液质量与产生沉淀质量关系如图所示.根据实验计算,该氯化钠溶液中溶质的质量分数是多少?
解:根据图象可知,当加入30克硝酸银溶液时,沉淀的质量达到最大值(2.87克),设需要氯化钠的质量是X.
NaCl+AgNO3═NaNO3+AgCl↓
58.5 143.5
x 2.87克
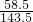 ═
═
得:X=1.17
∴溶液中氯化钠的质量分数= ×100%═11.7%.
×100%═11.7%.
答:溶液中氯化钠的质量分数为11.7%.
分析:观察图象可知,沉淀的质量的最大值是2.87克,然后写出化学方程式并代入沉淀的质量计算出氯化钠的质量,最后计算出溶液中溶质的质量分数.
点评:学会分析图象并从图象中得到信息的方法,一般观察图象的转折点;计算时注意计算格式和规范性.
NaCl+AgNO3═NaNO3+AgCl↓
58.5 143.5
x 2.87克
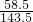 ═
═
得:X=1.17
∴溶液中氯化钠的质量分数=
 ×100%═11.7%.
×100%═11.7%.答:溶液中氯化钠的质量分数为11.7%.
分析:观察图象可知,沉淀的质量的最大值是2.87克,然后写出化学方程式并代入沉淀的质量计算出氯化钠的质量,最后计算出溶液中溶质的质量分数.
点评:学会分析图象并从图象中得到信息的方法,一般观察图象的转折点;计算时注意计算格式和规范性.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
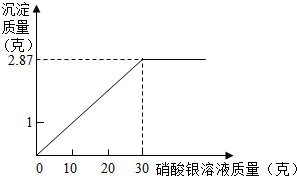 为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10克该氯化钠溶液,然后向其中加入AgNO3溶液,发生复分解反应生成AgCl沉淀.滴加硝酸银溶液质量与产生沉淀质量关系如图所示.根据实验计算,该氯化钠溶液中溶质的质量分数是多少?
为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10克该氯化钠溶液,然后向其中加入AgNO3溶液,发生复分解反应生成AgCl沉淀.滴加硝酸银溶液质量与产生沉淀质量关系如图所示.根据实验计算,该氯化钠溶液中溶质的质量分数是多少?