题目内容
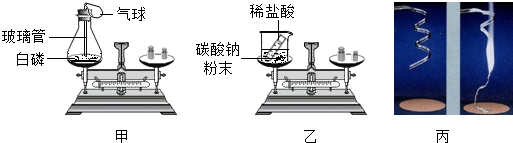
对比分析是化学学习基本方法,116班化学兴趣小组按如图所示的实验方案探究质量守恒定律.
【提出假设】物质发生化学变化前后总质量不变
【进行探究】完成实验记录
【交流讨论】通过分析,导致乙方案前后质量不相等的原因是 ,用天平称量镁条燃烧前后的质量,发现反应前的质量 (“不等于”或“等于”)反应后的质量.
【探究反思】在探究质量守恒定律时, 的反应必须在密闭装置中进行.

【提出假设】物质发生化学变化前后总质量不变
【进行探究】完成实验记录
| 实验现象 | 化学方程式 | |||||
| 甲方案 | 白磷燃烧,产生浓浓的白烟,放出热量,气球 |
4P+5O2
| ||||
| 乙方案 | 烧杯内产生大量气泡,天平不平衡 | | ||||
| 丙方案 | 镁条燃烧,发出白光 | |
【探究反思】在探究质量守恒定律时,
分析:根据质量守恒定律内容分析解答:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和;其中的关键词为:参加 生成 各物质 化学反应 质量总和等.
解答:解:(1)白磷燃烧有氧气的参加,反应后又有浓烟的产生,因此反应需在密闭容器中进行,所以能够验证参加化学反应的反应物的总质量和生成物的总质量相等.变化结合磷燃烧的现象和气球的变化,答案为:气球先变大后又变小,(2)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量和等于生成的氯化钠、水和二氧化碳的质量和,因有二氧化碳气体溢出,故反应后总质量比反应前总质量减少,观察到天平不平衡;烧杯内产生大量气泡,天平不平衡;答案为:Na2CO3+2HCl=2NaCl+H2O+CO2↑;
(3)镁条燃烧生成氧化镁,参加反应的是镁和氧气,生成的是氧化镁固体,根据质量守恒定律,生成的氧化镁固体质量等于参加反应的镁和氧气的质量和,但反应没有在密闭容器中进行了,所以燃烧后的总质量大于反应前的总质量,反应的方程式为:2Mg+O2
2MgO;
(4)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量和等于生成的氯化钠、水和二氧化碳的质量和,因有二氧化碳气体溢出,故反应后总质量比反应前总质量减少,
(5)答案为:不平衡
(6)天平不平衡的原因是有气体的参加反应或有气体、热量等的溢出,
答案为:(1)先鼓后瘪,(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑ (3)2Mg+O2
2Mg,(4)生成的气体逸散到空气中了(5)不等于(6)有气体生成或气体参加
(3)镁条燃烧生成氧化镁,参加反应的是镁和氧气,生成的是氧化镁固体,根据质量守恒定律,生成的氧化镁固体质量等于参加反应的镁和氧气的质量和,但反应没有在密闭容器中进行了,所以燃烧后的总质量大于反应前的总质量,反应的方程式为:2Mg+O2
| ||
(4)碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,根据质量守恒定律,参加反应的碳酸钠与氯化氢的质量和等于生成的氯化钠、水和二氧化碳的质量和,因有二氧化碳气体溢出,故反应后总质量比反应前总质量减少,
(5)答案为:不平衡
(6)天平不平衡的原因是有气体的参加反应或有气体、热量等的溢出,
答案为:(1)先鼓后瘪,(2)Na2CO3+2HCl=2NaCl+H2O+CO2↑ (3)2Mg+O2
| ||
点评:要验证质量守恒定律需根据反应物的状态和产物的状态选择敞口或密闭装置,若有气体参加或生成的反应需在密闭容器中进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
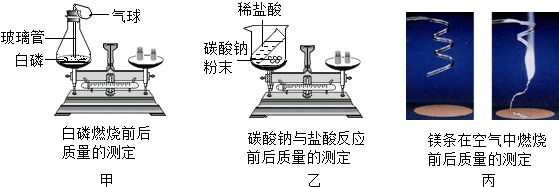
 对比分析是化学研究和学习基本方法.甲、乙、丙三位同学利用如图中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动.
对比分析是化学研究和学习基本方法.甲、乙、丙三位同学利用如图中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动.
[实验步骤]
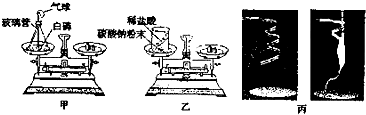
①如图所示,甲将白磷和反应装置、乙将装有稀盐酸的小试管和碳酸钠粉末的烧杯,分别放在两个托盘天平上,并用砝码使天平平衡.丙对石棉网和打磨干净的镁条进行称量.
②三位同学分别利用装置进行化学反应.
③甲、乙同学在反应结束且甲的装置冷却后,将反应装置及装置内的物质放在反应前使用的托盘天平上,观察天平是否平衡.丙同学实验结束后称量石棉网和石棉网上氧化镁的质量,比较反应前后质量.
[实验分析]
(1)请你仿照示例,完成实验现象的记录和分析.
| 实验现象 | |||
| 甲同学 | ________ | 4P+502 2P2O5 2P2O5 | 该反应遵守质量守恒定律 |
| 乙同学 | ________ | ________ | 该反应遵守质量守恒定律 |
| 丙同学 | 镁条剧烈燃烧,发出耀眼白光,放热,生成 白色固体.反应前后称量质量不相等. | ________ | 该反应不遵守质量守恒定律 |
A、酸 B、氧化物 C、碱 D、盐
(3)通过对上述实验的对比分析,甲乙两位同学发现丙同学的实验现象是正确的,但结论却是错误的.在实验操作完全正确的情况下,请分析导致丙同学实验前后称量质量不相等的原因有________.
实验结论:化学反应都遵守质量守恒定律.
实验反思:
(4)请从微观角度分析化学反应遵守质量守恒定律的原因是________.
对比分析是化学研究和学习基本方法.甲、乙、丙三位同学利用如图中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动.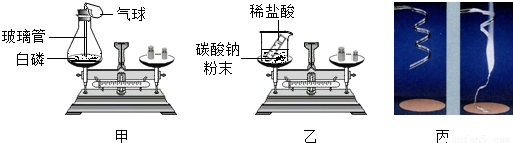
[实验步骤]
①如图所示,甲将白磷和反应装置、乙将装有稀盐酸的小试管和碳酸钠粉末的烧杯,分别放在两个托盘天平上,并用砝码使天平平衡.丙对石棉网和打磨干净的镁条进行称量.
②三位同学分别利用装置进行化学反应.
③甲、乙同学在反应结束且甲的装置冷却后,将反应装置及装置内的物质放在反应前使用的托盘天平上,观察天平是否平衡.丙同学实验结束后称量石棉网和石棉网上氧化镁的质量,比较反应前后质量.
[实验分析]
(1)请你仿照示例,完成实验现象的记录和分析.
(2)比较甲、丙同学的实验有许多相似之处,如生成物都属于下列选项中的 .
A、酸 B、氧化物 C、碱 D、盐
(3)通过对上述实验的对比分析,甲乙两位同学发现丙同学的实验现象是正确的,但结论却是错误的.在实验操作完全正确的情况下,请分析导致丙同学实验前后称量质量不相等的原因有 .
实验结论:化学反应都遵守质量守恒定律.
实验反思:
(4)请从微观角度分析化学反应遵守质量守恒定律的原因是 .

[实验步骤]
①如图所示,甲将白磷和反应装置、乙将装有稀盐酸的小试管和碳酸钠粉末的烧杯,分别放在两个托盘天平上,并用砝码使天平平衡.丙对石棉网和打磨干净的镁条进行称量.
②三位同学分别利用装置进行化学反应.
③甲、乙同学在反应结束且甲的装置冷却后,将反应装置及装置内的物质放在反应前使用的托盘天平上,观察天平是否平衡.丙同学实验结束后称量石棉网和石棉网上氧化镁的质量,比较反应前后质量.
[实验分析]
(1)请你仿照示例,完成实验现象的记录和分析.
| 实验现象 | |||
| 甲同学 | 4P+502 2P2O5 2P2O5 | 该反应遵守质量守恒定律 | |
| 乙同学 | 该反应遵守质量守恒定律 | ||
| 丙同学 | 镁条剧烈燃烧,发出耀眼白光,放热,生成 白色固体.反应前后称量质量不相等. | 该反应不遵守质量守恒定律 |
A、酸 B、氧化物 C、碱 D、盐
(3)通过对上述实验的对比分析,甲乙两位同学发现丙同学的实验现象是正确的,但结论却是错误的.在实验操作完全正确的情况下,请分析导致丙同学实验前后称量质量不相等的原因有 .
实验结论:化学反应都遵守质量守恒定律.
实验反思:
(4)请从微观角度分析化学反应遵守质量守恒定律的原因是 .
对比分析是化![]() 学研究和学习基本方法。甲、乙、丙三位同学利用图28中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动。
学研究和学习基本方法。甲、乙、丙三位同学利用图28中的装置,围绕“用称量的方法验证化学反应是否遵守质量守恒定律并分析实验条件”这一探究目的开展活动。
[实验步骤]
①如图28所示,甲将白磷和反应装置、乙将装有稀盐酸的小试管和碳酸钠粉末的烧杯,分别放在两个托盘天平上,并用砝码使天平平衡。丙对石棉网和打磨干净的镁条进行称量。
②三位同学分别利用![]() 装置进行化学反应。
装置进行化学反应。
③甲、乙同学在反应结束且甲的装置冷却后,将反应装置及装置内的物质放在反应前使用的托盘天平上,观察天平是否平衡。丙同学实验结束后称量石棉网和石棉网上氧化镁的质量,比较反应前后质量。

【实验分析】
(1)请你仿照示例,完成实验现象的记录和分析。
| 实验现象 |
| ||
| 甲 | ① | 4P+502 点燃//2P2O5 | 该反应遵守质量守恒定律 |
| 乙同学 | ② | ③ | 该反应遵守质量守恒定律 |
| 丙同学 | 镁条剧烈燃烧,发出耀眼白光,放热,生成 白色固体.反应前后称量质量不相等. | ④ | 该反应不遵守质量守恒定律 |
(2)比较甲、丙同学的实验有许多相似之处,如生成物都属于下列选项中的 。
A、酸 B、氧经物 C、碱 D、盐
(3)通过对上述实验的对比分析,甲乙两位同学发现丙同学的实验现象是正确的,但结论却是错误的。在实验操作完全正确的情况下,请分析导致丙同学实验前后称量质量不相等的原因有 ![]() 。
。
【实验结论】化学反应都遵守质量守恒定律。
【实验反思】(4)请从微观角度分析化学反应遵守质量守恒定律的原因是 。