题目内容
【题目】根据下列图示,回答问题

(1)图1中出现“蓝色火焰”的原因是______(用化学方程式解释);
(2)图2实验的目的是______,实验的结果是______。
(3)图3中向鱼缸中通入空气的目的是______。
(4)图4中大理石地板上洒了稀盐酸的现象是______,反应的化学方程式为______,其基本反应类型为______。
(5)图5中沼气主要成分的化学式为______,它属于______(“可”或“不可”)再生能源。
【答案】 比较黄铜和纯铜的硬度 黄铜硬度大 向水中补充氧气 产生气泡 CaCO3+2HCl═CaCl2+H2O+CO2↑ 复分解反应 CH4 可
比较黄铜和纯铜的硬度 黄铜硬度大 向水中补充氧气 产生气泡 CaCO3+2HCl═CaCl2+H2O+CO2↑ 复分解反应 CH4 可
【解析】
碳酸钙和盐酸反应生成氯化钙、水和二氧化碳。
(1)图1中出现“蓝色火焰”的原因一氧化碳燃烧生成二氧化碳,反应的化学方程式为 。
。
(2)图2是黄铜和纯铜相互刻画,合金硬度大,会看到纯铜上面有痕迹,故实验的目的是比较黄铜和纯铜的硬度,实验的结果是黄铜硬度大。
(3)氧气能供给呼吸,空气中含有氧气,故图3中向鱼缸中通入空气的目的是向水中补充氧气。
(4)碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,故图4中大理石地板上洒了稀盐酸的现象是产生气泡,反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑,反应符合两种化合物相互交换成分生成另两种化合物,属于复分解反应。
(5)图5中沼气主要成分是甲烷,甲烷的化学式为CH4,它属于可再生能源。

 怎样学好牛津英语系列答案
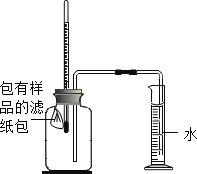
怎样学好牛津英语系列答案【题目】世界上每年因锈蚀而报废的金属设备和材料高达产量的20%~40%,某实验小组对铁的锈蚀和铁锈的成分进行如下探究。
(一)如图所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进入广口瓶。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表
序号 | 样品 | 量筒起始读数mL | 量筒最终读数mL | 所需时间/min |
① | 1g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
② | 1g铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
③ | -- | -- | -- | -- |
(1)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是______(填“放热”或吸热”)过程。
(2)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁锈蚀的速率。
(3)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成是______。
(二)为探究铁锈的成分,用如图所示装置(夹持仪器已省略)进行实验(每步反应和吸收均完全)。
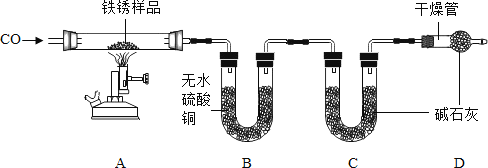
查阅资料:无水硫酸铜吸水会由白色变为蓝色,碱石灰既能吸水也能吸收CO2。
(4)该装置有一个明显缺陷是______。
(5)加热前,先通入CO一段时间,目的是______;将铁锈样品加热,无水硫酸铜逐渐变蓝,由此推知铁锈中一定含有______元素,从而推断出空气中的______参加了铁生锈反应。
(6)若将铁锈的成分表示为FexOynH2O,为了准确测定该成分,除要称量铁锈样品的质量外,还需要测定装置______(填标号)反应前后的质量。若缺少装置D,则测算出的x:y值将______(填“偏大”“偏小”或“无影响”)