题目内容
(2009?大兴区一模)在一烧杯中盛有100g CuSO4和H2SO4的混合溶液向其中逐渐滴加NaOH溶液,沉淀的质量与所滴入NaOH溶液的质量关系曲线如图所示.请根据题意回答下列问题:(2NaOH+CuSO4=Na2SO4+Cu(OH)2↓).(1)在实验过程中加入agNaOH溶液时,溶液中的溶质是______.
(2)在实验过程中加入80gNaOH溶液时所得溶液中溶质的质量为______g.
(3)求所加的NaOH溶液的溶质质量分数.(写出计算过程)
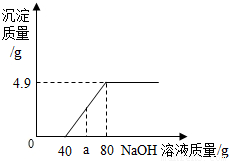
【答案】分析:(1)根据曲线可知,当加入当加入40g氢氧化钠溶液时,混合溶液中的硫酸完全反应,随后加入的氢氧化钠溶液开始与硫酸铜发生反应生成硫酸钠和氢氧化铜沉淀;至加入80g氢氧化钠溶液时完全反应;而40g<a<80g,因此可得知溶液中溶质为Na2SO4、CuSO4;
(2)由曲线可知,硫酸铜完全反应后可生成4.9g的氢氧化铜沉淀,根据质量守恒定律,由混合溶液的质量+所加氢氧化钠溶液质量-形成沉淀的质量=所得溶液的质量;
(3)根据氢氧化钠与硫酸铜反应的化学方程式,由生成沉淀氢氧化铜的质量可计算出与硫酸铜反应的80g-40g=40g氢氧化钠溶液中氢氧化钠的质量,利用溶液中溶质质量分数的计算公式,可求出所加的NaOH溶液的溶质质量分数.
解答:解:(1)根据沉淀的质量与所滴入NaOH溶液的质量关系曲线,当加入氢氧化钠溶液质量a g时,溶液中的硫酸已完全反应所加入的氢氧化钠溶液只和剩余的硫酸铜发生反应且未能反应完硫酸铜,因此,溶液中含有生成的硫酸钠和未反应的硫酸铜;故答案为:Na2SO4、CuSO4;
(2)由关系曲线可知,完全反应共产生沉淀的质量为4.9g;根据质量守恒定律,加入80gNaOH溶液时所得溶液中溶质的质量=100g+80g-4.9g=175.1g;
故答案为:175.1;
(3)设生成4.9g氢氧化铜沉淀所消耗氢氧化钠的质量为x
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
80 98
x 4.9g
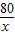 =
=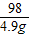 x=4g
x=4g
所加的NaOH溶液的溶质质量分数=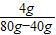 ×100%=10%
×100%=10%
答:所加的NaOH溶液的溶质质量分数为10%.
点评:分析沉淀的质量与所滴入NaOH溶液的质量关系曲线时,曲线起点表明混合溶液中硫酸恰好完全反应,曲线折点表明硫酸铜完全反应生成沉淀质量达最大值.
(2)由曲线可知,硫酸铜完全反应后可生成4.9g的氢氧化铜沉淀,根据质量守恒定律,由混合溶液的质量+所加氢氧化钠溶液质量-形成沉淀的质量=所得溶液的质量;
(3)根据氢氧化钠与硫酸铜反应的化学方程式,由生成沉淀氢氧化铜的质量可计算出与硫酸铜反应的80g-40g=40g氢氧化钠溶液中氢氧化钠的质量,利用溶液中溶质质量分数的计算公式,可求出所加的NaOH溶液的溶质质量分数.
解答:解:(1)根据沉淀的质量与所滴入NaOH溶液的质量关系曲线,当加入氢氧化钠溶液质量a g时,溶液中的硫酸已完全反应所加入的氢氧化钠溶液只和剩余的硫酸铜发生反应且未能反应完硫酸铜,因此,溶液中含有生成的硫酸钠和未反应的硫酸铜;故答案为:Na2SO4、CuSO4;
(2)由关系曲线可知,完全反应共产生沉淀的质量为4.9g;根据质量守恒定律,加入80gNaOH溶液时所得溶液中溶质的质量=100g+80g-4.9g=175.1g;
故答案为:175.1;
(3)设生成4.9g氢氧化铜沉淀所消耗氢氧化钠的质量为x
2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
80 98
x 4.9g
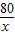 =
=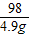 x=4g
x=4g所加的NaOH溶液的溶质质量分数=
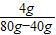 ×100%=10%
×100%=10%答:所加的NaOH溶液的溶质质量分数为10%.
点评:分析沉淀的质量与所滴入NaOH溶液的质量关系曲线时,曲线起点表明混合溶液中硫酸恰好完全反应,曲线折点表明硫酸铜完全反应生成沉淀质量达最大值.

练习册系列答案
相关题目