题目内容
【题目】学习了MnO2对过氧化氢分解有催化作用的知识后,某同学想:CuO能否起到类似MnO2的催化剂作用呢?于是进行了以下探究.
(1)【猜想】Ⅰ.CuO不是催化剂、也不参与反应,反应前后质量和化学性质不变; Ⅱ.CuO参与反应产生O2 , 反应前后质量和化学性质发生了改变;
Ⅲ.
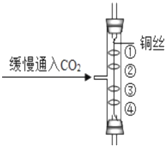
(2)【实验】用天平称量0.2gCuO,取5mL5%过氧化氢溶液于试管中,进行如图实验: 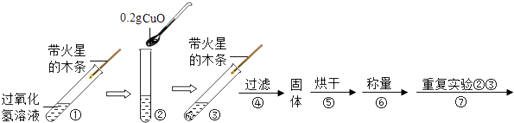 (i)填表:
(i)填表:
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
无明显现象. | 无明显现象 | 猜想Ⅰ成立 | |
产生大量气泡,带火星木条复燃. | 不等于0.2g | 产生大量气泡,带火星木条复燃 | 猜想Ⅱ成立 |
产生大量气泡,带火星木条复燃 | 猜想Ⅲ成立 |
(ii)步骤①的目的是;
步骤⑦的目的是;
为了确保实验的严谨与可靠性,步骤⑦中应选用的过氧化氢溶液.
(iii)步骤④需用到的玻璃仪器有:
(iv)写出氧化铜加入过氧化氢溶液中所发生的反应的化学方程式 .
【答案】
(1)CuO是催化剂,反应前后质量和化学性质不变
(2)0.2g;0.2g;产生大量气泡,带火星木条复燃;对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率;验证氧化铜反应前后额化学性质是否改变;5mL5%;漏斗、烧杯、玻璃棒;2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
【解析】解:(1)Ⅲ、催化剂的特点是“一变,两不变”,即反应速率变,质量和化学性质不变.故猜想为:CuO是催化剂,反应前后质量和化学性质不变;(2)(i)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故现象是有气泡,带火星的木条复燃;催化剂的特点是“一变,两不变”,反应前后其质量不变,所以氧化铜的质量仍为0.2g;催化剂的特点是“一变,两不变”,其中反应速率改变,这里是加快,所以现象是溶液中有气泡放出,带火星的木条复燃.(ii)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论. 步骤①的目的是:对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率;
步骤⑦的目的是:验证氧化铜反应前后额化学性质是否改变;
为了确保实验的严谨与可靠性,步骤⑦中应选用5mL5%过氧化氢溶液;(iii)过滤用到的玻璃仪器有:漏斗、烧杯、玻璃棒;(iv)双氧水反应生成水和氧气,过氧化氢能被CuO催化分解放出O2的化学方程式为2H2O2 ![]() 2H2O+O2↑.
2H2O+O2↑.
所以答案是:(1)Ⅲ、CuO是催化剂,反应前后质量和化学性质不变;(2)(i)
步骤③现象 | 步骤⑥结果 | 步骤⑦现象 | 结论 |
无明显现象. | 0.2g | 无明显现象 | 猜想Ⅰ成立 |
产生大量气泡,带火星木条复燃. | 不等于0.2g | 产生大量气泡,带火星木条复燃 | 猜想Ⅱ成立 |
产生大量气泡,带火星木条复燃 | 0.2g | 产生大量气泡,带火星木条复燃 | 猜想Ⅲ成立 |
(ii)对比实验,比较过氧化氢在有无氧化铜的情况下的分解速率;验证氧化铜反应前后额化学性质是否改变;5mL5%;(iii)漏斗、烧杯、玻璃棒;(iv)2H2O2 ![]() 2H2O+O2↑.
2H2O+O2↑.
【考点精析】掌握催化剂的特点与催化作用是解答本题的根本,需要知道催化剂(触媒):在化学反应中能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质.(一变两不变)催化剂在化学反应中所起的作用叫催化作用.

 应用题作业本系列答案
应用题作业本系列答案