题目内容
【题目】某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
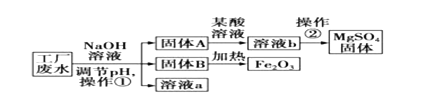
(1)固体A为________,固体B为________.
(2)固体A与某酸反应的化学方程式为_______。操作②时,当__________即可停止加热。
(3)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_________。
(4)溶液a除了可能含有NaOH外,还一定含有的溶质是_______________(填化学式)。
【答案】氢氧化镁Mg(OH)2 氢氧化铁Fe(OH)3 H2SO4+Mg(OH)2═MgSO4+2H2O 析出大量晶体 H2O NaCl、Na2SO4
【解析】
工业废水加入氢氧化钠溶液,则会与硫酸镁反应生成氢氧化镁沉淀,与氯化铁反应生成氢氧化铁沉淀,A中加入某酸以后得到的是硫酸镁,故酸是硫酸,固体A是氢氧化镁;固体B加热得到的是氧化铁,故B是氢氧化铁,溶液a中含有生成的氯化钠和硫酸钠;
(1)固体A为氢氧化镁,固体B为氢氧化铁;
(2)固体A为氢氧化镁,与硫酸反应生成硫酸镁和水,化学方程式为:H2SO4+Mg(OH)2═MgSO4+2H2O;操作②是蒸发结晶,当析出大量晶体即可停止加热;
(3)固体B是氢氧化铁,加热的产物是两种常见氧化物,则另一种氧化物是水,故填:H2O;(4)溶液a中含有生成的氯化钠和硫酸钠,故填:NaCl、Na2SO4。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目