题目内容
某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
 (2)样品中Na2CO3的质量分数;
(2)样品中Na2CO3的质量分数;
(3)反应后所得溶液中溶质的质量分数。
解:⑴根据质量守恒定律,生成CO2质量=20 g+6 g+26.2 g-50 g=2.2 g …… 1分
⑵设Na2CO3的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+CO2 ↑+H2O ……………………………1分
 106
106  117 44
117 44
x y 2.2 g ………………………………0.5分
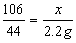
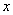 =5.3 g …………………………………0.5分
=5.3 g …………………………………0.5分
则样品中Na2CO3的质量分数=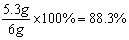 ……………………0.5分
……………………0.5分
⑶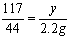 y=5.85 g …………………………………0.5分
y=5.85 g …………………………………0.5分
反应后溶液中溶质NaCl的质量为:5.85 g+(6 g-5.3 g)=6.55 g ……0.5分
则反应后溶液中溶质质量分数=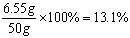
 …………………0.5分
…………………0.5分
答:⑴产生CO2质量为2.2 g;
⑵样品中Na2CO3质量分数为88.3%;
⑶反应后所得溶液中溶质质量分数为13.1%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目