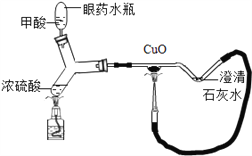
题目内容
【题目】以重晶石(主要成分是BaSO4,含Al、Fe等元素的杂质)为原料制备产品(BaCl22H2O)的一种流程如下:
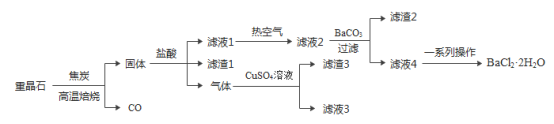
已知:(1)滤液2主要含BaCl2,还含有AlCl3、FeCl3和HCl等杂质。
(2)25℃下,Fe(OH)3、Al(OH)3完全沉淀的pH依次为3.0和5.4。
(3)BaCl22H2O受热易失去结晶水。
回答下列问题:
(1)高温焙烧时将重晶石粉碎的目的是_____。焙烧后,除生成CO,还生成一种只含两种元素的化合物,请写出BaSO4与C反应的化学方程式:_____。
(2)“固体”(微溶于水)与盐酸发生复分解反应,生成的一种气体通入CuSO4溶液中也发生复分解反应,则滤渣3的成分是_____(填化学式)。
(3)加入BaCO3的目的是调节溶液的pH,pH至少要达到_____(填“3.0”或“5.4”),测定此pH应该选择_____(填“广泛pH试纸”或“pH计”)。
(4)滤液4经蒸发浓缩、_____、过滤、洗涤和干燥,得到产品。经常选用95%的乙醇洗涤,优点是:①BaCl22H2O难溶于乙醇,能降低晶体损耗;②_____。
【答案】增大反应物的接触面积,使反应更快更充分 BaSO4+4C![]() 4CO↑+BaS CuS 5.4 pH计 降温结晶 便于快速干燥
4CO↑+BaS CuS 5.4 pH计 降温结晶 便于快速干燥
【解析】
(1)高温焙烧时将重晶石粉碎的目的是:增大反应物的接触面积,使反应更快更充分。焙烧后,除生成CO,还生成一种只含两种元素的化合物,根据元素守恒,硫酸钡与碳高温条件下反应产生二氧化碳和硫化钡,反应的化学方程式:BaSO4+4C![]() 4CO↑+BaS。
4CO↑+BaS。
(2)硫化钡与盐酸发生复分解反应产生氯化钡和硫化氢气体,生成硫化氢通入CuSO4溶液中也发生复分解反应产生硫化铜沉淀和硫酸,则滤渣3的成分是硫化铜(CuS)。
(3)加入BaCO3的目的是调节溶液的pH,pH至少要达到5.4,此时氢氧化铁和氢氧化铝能够完全沉淀;测定此pH应该选择pH计更准确,因为pH试纸测得的为数值为整数,不够准确;。
(4)滤液4经蒸发浓缩、降温结晶、过滤、洗涤和干燥,得到产品。经常选用95%的乙醇洗涤,优点是:①BaCl22H2O难溶于乙醇,能降低晶体损耗;②乙醇易挥发,便于快速干燥,得到目标产物BaCl22H2O。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】下列有关反应的化学方程式、现象,操作均符合事实的是 ( )
A | B | C | D |
铁在氧气中燃烧 | 红磷在空气中燃烧 | 镁在空气中燃烧 | 硫在氧气中燃烧 |
4Fe+3O2 | 4P+5O2 | 2Mg+O2 | S+O2 |
剧烈燃烧火星四射 | 产生白烟,放热 | 产生强白光,放出白烟 | 产生明亮蓝紫色火焰,生成黄色刺激性气味气体 |
集气瓶底部放水可防止炸裂 | 应防止生成物逸散,污染大气 | 应用镊子夹持镁条进行试验 | 集气瓶底部放水或细沙防止污染大气 |
A.AB.BC.CD.D
【题目】探究二氧化碳溶于水时,二氧化碳是否与水发生了反应。某实验小组用塑料矿泉水瓶和集气瓶收集了若干瓶干燥的二氧化碳气体,并准备了一些用石蕊溶液染成的紫色小花,进行如下实验:
Ⅰ.在充满二氧化碳的塑料瓶中小心加入1/3的蒸馏水,拧紧瓶盖充分振荡,塑料瓶变扁;
Ⅱ.取Ⅰ中瓶内液体喷到紫色的干燥的小花上,小花立即变红;
Ⅲ.变红的小花放在酒精灯上方小心烘烤片刻,红色小花又变成紫色。
回答下列问题:(1)实验Ⅰ中同学们一致认为塑料瓶变扁的原因是瓶中的二氧化碳减少了,在进一步思考气体变少的原因时,出现了两种不同的意见,你认为可能是:_____或____;
(2)针对实验Ⅱ小花变红的事实,同学们提出三种猜测:①二氧化碳能使石蕊变红;②水使石蕊变红;③二氧化碳与水反应生成了一种新的物质能使石蕊变红。
于是设计实验,最后证明使石蕊变红的不是二氧化碳和水,而是它们反应生成的一种新的物质,请你完成实验报告:
实验操作 | 实验现象 | 结论 |
将水喷到紫色的干燥的小花上 | ______ | 使石蕊变红的不是水 |
将紫色的干燥的小花放到盛有CO2的瓶子中 | _______ | 使石蕊变红的不是二氧化碳 |
(3)实验操作Ⅲ中发生的化学反应方程式_____。