题目内容
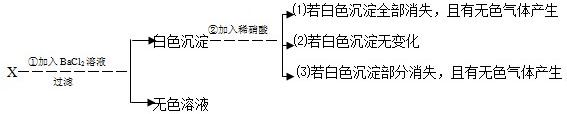
含钠元素的某白色固体X易溶于水,取少量溶液进行如下实验: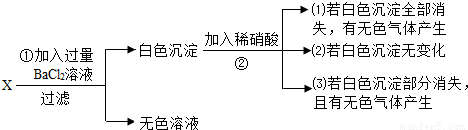
回答下列问题:
由现象(1)推知X为(写化学式,下同)______,反应②的化学方程式
______;
由现象(2)推知X为______,反应①的化学方程式为______;
由现象(3)推知X为______.无色溶液中溶质的化学式为______.
(1)根据上述分析可知X的化学式,根据复分解反应的特点写出该反应的化学方程式.
(2)根据上述分析可知X的化学式,根据复分解反应的特点写也该反应的化学方程式.
(3)根据上述分析可知X的化学式,根据所发生的反应判断无色溶液中的溶质有哪些.
解答:解:由上述分析可知白色沉淀为硫酸钡或碳酸钡,X为硫酸钠或碳酸钠.
(1)白色沉淀全部消失,有无色气体生成,则白色沉淀为碳酸钡,X为碳酸钠,②发生的反应为碳酸钡和硝酸发生的反应.故答案为:Na2CO3 BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O
(2)白色沉淀无变化,则白色沉淀为硫酸钡,X为硫酸钠,①发生的反应为硫酸钠与氯化钡发生的反应.故答案为:Na2SO4 Na2SO4+BaCl2=BaSO4↓+2NaCl
(3)白色沉淀部分消失,有无色气体生成,则白色沉淀为碳酸钡和硫酸钡的混合物,X为碳酸钠和硫酸钠的混合物.①发生的反应为Na2CO3+BaCl2=BaCO3↓+2NaCl和Na2SO4+BaCl2=BaSO4↓+2NaCl则无色溶液中的溶质除了有反应生成的NaCl外,还有剩余的BaCl2.
故答案为:Na2CO3、Na2SO4、NaCl和BaCl2
点评:做本题的关键是要熟练掌握一些常用的特殊离子对,掌握离子之间发生的反应及现象,如本题中有关离子反应的现象是:钡离子和硫酸根离子反应生成硫酸钡沉淀、钡离子和碳酸根离子反应生成碳酸钡沉淀、碳酸根离子和氢离子反应生成水和二氧化碳,有气泡冒出.

 阅读快车系列答案
阅读快车系列答案含钠元素的某白色固体X易溶于水,取少量溶液进行如下实验:
 |
据以上实验和资料回答下列问题:
由现象(1)推知X为(写化学式,下同)_______________,
反应②的化学方程式
__________________________________________;
由现象(2)推知X为_______________,反应①的化学方程式为
________________ _________________________;
由现象(3)推知X为__________________________。
无色溶液中溶质的化学式为
__________________ _________。
含钠元素的某白色固体X易溶于水,取少量溶液进行如下实验:
 |
据以上实验和资料回答下列问题:
由现象(1)推知X为(写化学式,下同)_______________,
反应②的化学方程式
__________________________________________;
由现象(2)推知X为_______________,反应①的化学方程式为
________________ _________________________;
由现象(3)推知X为__________________________。
无色溶液中溶质的化学式为
__________________ _________。