题目内容
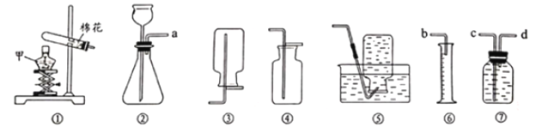
【题目】欲用锌和稀硫酸反应制取氢气,然后利用氢气测定某CuO样品中含CuO的质量分数(假设杂质不挥发,也不发生反应),仪器的连接顺序为:B→A1→C→A2→A3。(已知:CuO+H2![]() Cu+H2O;其中 A1、A2、A3为3个浓硫酸洗气瓶)欲通过测量反应前后A2浓硫酸洗气瓶的质量变化来测算某CuO样品中含CuO的质量分数。
Cu+H2O;其中 A1、A2、A3为3个浓硫酸洗气瓶)欲通过测量反应前后A2浓硫酸洗气瓶的质量变化来测算某CuO样品中含CuO的质量分数。
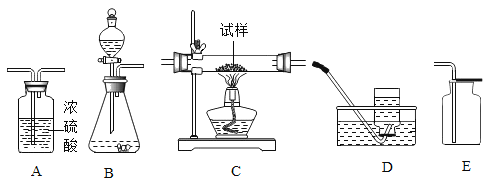
(1)C处大玻璃管内看到的主要实验现象是___________________。
(2)若测得洗气瓶A2的质量增加1.8g,则C处大玻璃管内的物质总质量应该减少____g。
【答案】黑色固体变红色 1.6
【解析】
⑴根据题意C处大玻璃管内发生的反应是氢气和氧化铜反应生成铜和水,氧化铜是黑色,铜是红色,所以C处大玻璃管内看到的主要实验现象是:黑色固体变红色。
⑵根据仪器的连接顺序:B→A1→C→A2→A3,B中生成的氢气经过A1干燥,得到干燥的氢气,在C装置中氢气和氧化铜反应生成水,生成的水在加热时成为水蒸气被A2吸收, A3的作用是防止A2吸收空气中的水蒸气。若测得洗气瓶A2的质量增加1.8g,就说明反应中生成水1.8g,从反应![]() 看出,水中的氧来自氧化铜,所以水中氧元素的质量等于氧化铜中氧元素的质量,因此C处大玻璃管内的物质总质量减少的量=
看出,水中的氧来自氧化铜,所以水中氧元素的质量等于氧化铜中氧元素的质量,因此C处大玻璃管内的物质总质量减少的量=![]() =1.6g。
=1.6g。

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目